Nye in-silico-designede proteinprober kunne bane vejen for tidlig diagnose af neurodegenerative sygdomme
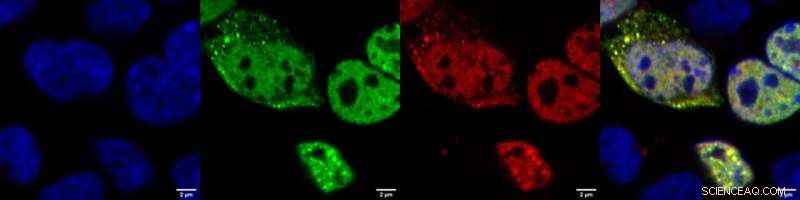
Zoom ind på enkeltdyrkede pattedyrceller, hvori TDP-43 er blevet induceret til at aggregere. I dette system producerer cellerne TDP-43 fusioneret til et grønt fluorescerende molekyle, for at kunne detektere om proteinet danner uopløselige granula (grønne fluorescerende prikker). RNA-proben er mærket med et rødt fluorescerende mærke. Den gule farve, givet af overlapningen mellem den grønne af TDP-43 og den røde af RNA-proben, betyder, at proben kan søge og finde sit proteinmål i levende celler, hvilket tyder på, at det kunne bruges som et detektionsværktøj til at spore udviklingen af TDP-43-aggregation i sygdom.Blå:kerner; grøn:TDP-43; rød:RNA-probe; gul:TDP-43+RNA-probe. Kredit:IIT-Istituto Italiano di Tecnologia
Et team af forskere fra IIT-Istituto Italiano di Tecnologia (Italiensk Institut for Teknologi) har designet i silico "molekylære prober", der er i stand til at spore udviklingen af et protein, der opfører sig forkert i forskellige neurodegenerative sygdomme, såsom amyotrofisk lateral sklerose (ALS) og Fronto-Temporal Demens (FTD). Proberne kan bruges til at studere adfærden af målproteinet i en celle og blev testet i samarbejde med Sapienza University of Rome, Center for Genomic Regulation n Barcelona, University of Edinburgh og Kings College London. Forskningsstudiet er blevet offentliggjort i Nature Communications.
Skabt af "RNA Systems Biology"-gruppen ved IIT i Genova, proberne består af computerdesignede RNA-molekyler, der binder til et neurodegenerationsassocieret protein ved navn TDP-43. Dette protein er til stede i adskillige tilfælde af amyotrofisk lateral sklerose (ALS) og fronto-temporal demens (FTD), hvor det aggregeres og skaber uopløselige proteinklatter i neurale celler, hvilket ændrer deres stofskifte og funktion.
Forskerholdet blev inspireret af proteinets naturlige interaktioner med RNA-molekyler til at designe molekylære prober, som kaldes "aptamerer", bogstaveligt talt molekyler lavet til at passe til et enkelt mål. Deres hovedmål var at opnå en ny tilgang til sporing af aggregeringen af neurodegeneration-associerede proteiner i de allerførste trin af processen.
"Ved at bruge vores egne algoritmer designede vi RNA-aptamerer, der er specifikke for TDP-43 og brugte dem sammen med avancerede mikroskopiteknikker til at følge proteinovergangen mod dets aggregerede former," forklarer Gian Gaetano Tartaglia, hovedforsker ved RNA System Biology Lab. "Vi kan identificere TDP-43-aggregater så små som 10 nanometer, hvilket, så vidt vi ved, er den bedste opløsning, der er opnået hidtil, når vi visualiserer proteinaggregater."
Zoom ind på enkeltdyrkede pattedyrsceller, hvori TDP-43 er blevet induceret til at aggregere. I dette system producerer cellerne TDP-43 fusioneret til et grønt fluorescerende molekyle, for at kunne detektere, om proteinet danner uopløselige granulat (grønt fluorescerende) prikker). RNA-proben er mærket med et rødt fluorescerende mærke. Den gule farve, givet af overlapningen mellem den grønne af TDP-43 og den røde af RNA-proben, betyder, at proben kan søge og finde sit proteinmål i levende celler, hvilket tyder på, at det kunne bruges som et detektionsværktøj til at spore udviklingen af TDP-43-aggregation i sygdom. Blå:kerner; grøn:TDP-43; rød:RNA-probe; gul:TDP-43+RNA-probe. Kredit:IIT-Istituto Italiano di Tecnologia
Disse aptamerer kunne bruges til at studere, på molekylært niveau, fænomenet med unormal proteinaggregering, der er typisk for adskillige neurodegenerative sygdomme, og ville derfor bane vejen for udviklingen af tidlige diagnoseværktøjer for disse lidelser.
"Vi viste, at RNA-aptamererne også kan bruges til at spore TDP-43 i levende celler og i realtid, ved at detektere alle former for proteinet, fra den fysiologisk opløselige til den uopløselige tilstand, der passerer forbi aggregater af mellemstørrelser, der ikke kan påvises ved standard. tilgange," tilføjer Elsa Zacco, ledende forsker på projektet. + Udforsk yderligere
Hvordan proteinaggregering sker i celler
Sidste artikelForskning forbedres i forhold til konventionelle LED-skærme
Næste artikelEn ny vej mod spin-polariserede strømme
 Varme artikler
Varme artikler
-
 Strammere syninger giver bedre grafenFalsk-farve mikroskopi billeder viser eksempler på grafen vokset langsomt, resulterer i store pletter med dårlige syninger, og grafen voksede hurtigere, hvilket resulterer i mindre pletter med stramme
Strammere syninger giver bedre grafenFalsk-farve mikroskopi billeder viser eksempler på grafen vokset langsomt, resulterer i store pletter med dårlige syninger, og grafen voksede hurtigere, hvilket resulterer i mindre pletter med stramme -
 Lyskontrollerede nanopartikler vil spille en nøglerolle i udviklingen af biosensorerKredit:CC0 Public Domain Forskere fra ITMO University har udviklet en produktionsmetode til biointegrerbare nanopartikler, der kan styres via varme. Med lys bestråling, disse partikler ændrer ikke
Lyskontrollerede nanopartikler vil spille en nøglerolle i udviklingen af biosensorerKredit:CC0 Public Domain Forskere fra ITMO University har udviklet en produktionsmetode til biointegrerbare nanopartikler, der kan styres via varme. Med lys bestråling, disse partikler ændrer ikke -
 Robotter på størrelse med bakterier tager imod mikroplastik og vinder ved at nedbryde demMetalliske mikrorobotter (mørkeblå prikker) koloniserer et takket stykke mikroplast under synligt lys, nedbryde plastikken til mindre molekyler. Kredit:Tilpasset fra ACS Applied Materials &Interfaces
Robotter på størrelse med bakterier tager imod mikroplastik og vinder ved at nedbryde demMetalliske mikrorobotter (mørkeblå prikker) koloniserer et takket stykke mikroplast under synligt lys, nedbryde plastikken til mindre molekyler. Kredit:Tilpasset fra ACS Applied Materials &Interfaces -
 DNA -nanoswitches afslører, hvordan livsmolekyler forbinderEt komplekst samspil mellem molekylære komponenter styrer næsten alle aspekter af biologiske videnskaber - sund organismeudvikling, sygdomsprogression, og lægemiddeleffektivitet afhænger alle af den m
DNA -nanoswitches afslører, hvordan livsmolekyler forbinderEt komplekst samspil mellem molekylære komponenter styrer næsten alle aspekter af biologiske videnskaber - sund organismeudvikling, sygdomsprogression, og lægemiddeleffektivitet afhænger alle af den m
- Effektiv glycopeptidseparation opnået ved grænseflade polymeriserede polymerpartikler
- Cybersikkerhedsteam, der ikke interagerer meget, klarer sig bedst
- Forskning finder kystveje under ny trussel fra stigende havniveau
- Sådan beregnes bremsemoment
- OmniTact:En kompakt og højopløsnings taktil sensor til robotapplikationer
- Varme elektroner høstet uden tricks


