Nano-protein corona forstyrrer proteinhomeostase og omformer cellemetabolisme
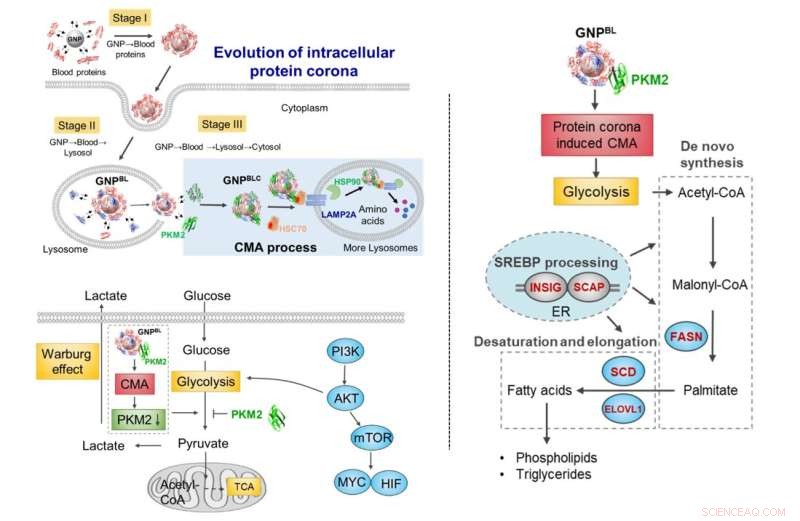
Udvikling af nano-protein corona under celletransport. Under transport fra blod-lysosomal-cytoplasmaet udløser udvekslingen af komponenter i proteincoronaen med intracellulære proteiner (chaperoneproteiner, metaboliske kinaser) en stigning i chaperoneproteinmedieret autofagiaktivitet og omformer selektivt cellemetabolisme. Kredit:Chen Chunying et al.
Et forskerhold ledet af prof. Chen Chunying fra National Center for Nanoscience and Technology (NCNST) under det kinesiske videnskabsakademi (CAS) har for nylig undersøgt udviklingen af nanoprotein-corona under endocytose og dets forstyrrelse af proteinhomeostase og celle stofskifte. Deres resultater blev offentliggjort i PNAS .
Når nanopartikler kommer ind i biologiske systemer, binder biomolekyler af biologisk væske sig hurtigt til overfladen af nanopartiklerne. Nano-protein-coronaen, der dannes ved at interagere med proteinmolekyler i blodet som et starttrin, har en enorm indflydelse på nanopartiklernes transport og skæbne. Hvordan dannelsen af nanoproteinet corona påvirker genkendelsen, transporten, distributionen, funktionen og de biologiske virkninger af nanopartikler i væv og celler i forskellige barrieresystemer er en "sort boks" til medicinsk anvendelse af nanomaterialer, som ikke kun begrænser leveringen effektiviteten af nanomedicin, men påvirker også i høj grad effektiviteten og sikkerheden.
En vigtig udfordring på dette område er kompleksiteten af nanoproteinet corona, som er påvirket af mangfoldigheden af biomolekyler i forskellige væv og organer, samt fysiologiske og patologiske tilstande. På nuværende tidspunkt er der et presserende behov for at forstå, hvordan proteinsammensætningen og strukturelle egenskaber af proteinkoronaen udvikler sig inden for biologiske mikromiljøer.
For at løse dette problem har forskerne afsløret det dynamiske udviklingsmønster af proteinsammensætningen af nano-protein-coronaen i processen med celletransport gennem den innovative anvendelse af multi-dimensionelle multi-omics (proteomics, metabolomics, lipidomics), intermolekylære interaktioner og in situ massespektrometrisk billeddannelse.
Med guldnanopartikler som model blev den dynamiske udviklingsproces af proteinkoronaen fra blodsystemet til det intracellulære (blod-lysosomale-cytoplasma) undersøgt. Når nanopartiklerne blev endocyteret ind i lysosomet fra blodmiljøet og derefter undslap fra lysosomet ind i cytoplasmaet, ville proteinsammensætningen på overfladen af nanopartiklerne ændre sig dramatisk. De fleste blev erstattet af intracellulære proteinmolekyler, der kun beholdt en del af proteinkoronakomponenterne dannet i blodmiljøet.
Efterfølgende forstyrrede intracellulær udvikling af nanoprotein-coronaen ikke kun intracellulær proteinhomeostase (proteostase), men udløste også berigelsen af chaperoneproteiner (HSC70, HSP90) og pyruvatkinase M2 (PKM2) på overfladen af den intracellulære nano-corona, og stimuleret chaperone-medieret autofagi. Det påvirkede yderligere celleglykolyse, hvilket forårsagede ændringer i cellens energimetabolisme og regulerede cellelipidmetabolismeprocessen.
Denne undersøgelse belyser det evolutionære mønster af nanopartikler fra blod til et subcellulært mikromiljø og identificerer specificiteten af det intracellulære mikromiljø af nano-protein corona, og omformer derved cellemetabolismen. Det giver også teoretisk støtte til en dybdegående forståelse af de komplekse biologiske effekter af nanomaterialer og nanobiotisk grænsefladeregulering. + Udforsk yderligere
Virkningerne af protein corona på interaktionerne af AIE-visualiserede liposomer med ce
 Varme artikler
Varme artikler
-
 Forskere laver sølv nanotråde baseret på DNA -molekylerEn illustration, der viser GC-DNA før (venstre) og efter (højre) metallisering. Kredit:Moskva Institut for Fysik og Teknologi Et team af forskere fra Rusland og Israel, herunder forskere fra MIPT,
Forskere laver sølv nanotråde baseret på DNA -molekylerEn illustration, der viser GC-DNA før (venstre) og efter (højre) metallisering. Kredit:Moskva Institut for Fysik og Teknologi Et team af forskere fra Rusland og Israel, herunder forskere fra MIPT, -
 Nye grafen-baserede neurale prober forbedrer detektion af epileptiske hjernesignalerKredit:Pixabay/CC0 Public Domain Ny forskning offentliggjort i dag har vist, at bittesmå graphene neurale prober kan bruges sikkert til i høj grad at forbedre vores forståelse af årsagerne til epil
Nye grafen-baserede neurale prober forbedrer detektion af epileptiske hjernesignalerKredit:Pixabay/CC0 Public Domain Ny forskning offentliggjort i dag har vist, at bittesmå graphene neurale prober kan bruges sikkert til i høj grad at forbedre vores forståelse af årsagerne til epil -
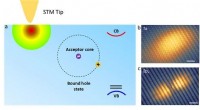 Rumlig struktur af bundne hultilstande i sort fosfor(a) Illustration af STM-teknikken til sondering af bundne hultilstande i BP. (b) Elliptisk form observeret for de jordbundne hultilstande (1s-lignende). (c) håndvægtform observeret for den ophidsede b
Rumlig struktur af bundne hultilstande i sort fosfor(a) Illustration af STM-teknikken til sondering af bundne hultilstande i BP. (b) Elliptisk form observeret for de jordbundne hultilstande (1s-lignende). (c) håndvægtform observeret for den ophidsede b -
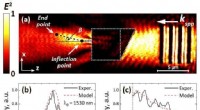 Buede plasmoniske fluxer afslører en ny måde til praktisk lysmanipulation inden for nanoscalKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytekniske Universitet har sammen med russiske kolleger og forskere fra Danmarks Tekniske Universitet for første gang eksperimentelt
Buede plasmoniske fluxer afslører en ny måde til praktisk lysmanipulation inden for nanoscalKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytekniske Universitet har sammen med russiske kolleger og forskere fra Danmarks Tekniske Universitet for første gang eksperimentelt
- Temperaturen og klimaet i det gamle mesopotamia
- Hvad er Jordens største trussel mod biodiversitet?
- Tankskibskollision spildte 400 tons olie ud for Kinas kyst:myndigheder
- Sådan finder du en brøkdel af et tal
- Økonomer finder blandede værdier af tanker og bønner
- Blanding af laserstråler og røntgenstråler


