Injicerbar stamcellesamling til bruskregenerering
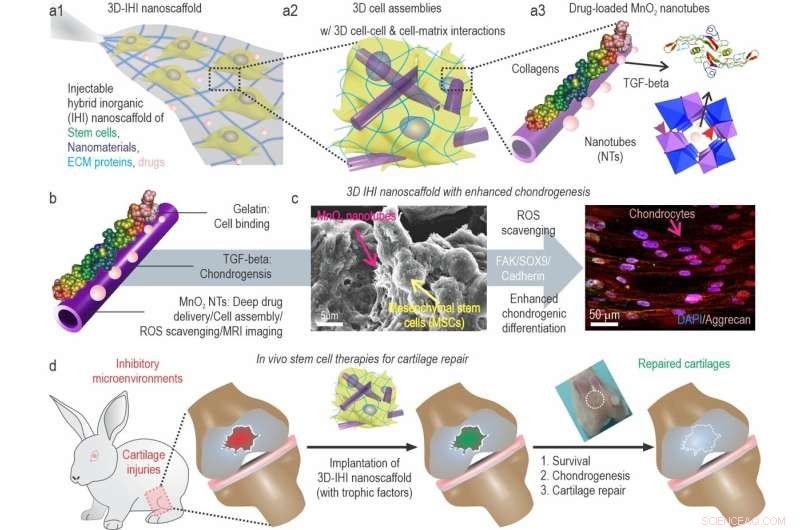
a) En skematisk illustration af 3D TGFβ-BMSC-IHI nanoscaffold. b) Den skematiske illustration af gelatinebelagt og TGF-β3-ladet MnO2 NT'er. c) FESEM-billedet indikerede, at de fleste af BMSC'erne danner kontakter med andre celler og de 1D fibrill-lignende strukturer, som lignede strukturerne i naturlige væv. d) Ved at ombygge det oxidative mikromiljø, forbedre cellelevedygtighed og chondrogenese af transplanterede celler, kunne bruskregenerering endelig opnås. Kredit:Science China Press
En undersøgelse ledet af Prof. Qiuyu Zhang (Northwestern Polytechnical University), Prof. Ki-Bum Lee (Rutgers University) og Prof. Liang Kong (School of Stomatology, The Fourth Military Medical University) har etableret en injicerbar hybrid uorganisk (IHI) nanoscaffold-skabelon stamcellesamling og anvendte den til regenerering af kritisk store bruskdefekter.
Bruskskader er ofte ødelæggende, og de fleste af dem har ingen helbredelse på grund af bruskvævets iboende lave regenereringsevne. Fremkomsten af 3D-stamcellekultursystemer har ført til gennembrud inden for udviklingsbiologi, sygdomsmodellering og regenerativ medicin. For eksempel kunne stamceller, når de først er transplanteret med succes, oprindeligt hemmelige trofiske faktorer til at reducere inflammation på steder med bruskskader og derefter differentiere til bruskceller (f.eks. chondrocytter) til funktionel genopretning.
Ikke desto mindre er der kritiske barrierer, der skal overvindes, før det terapeutiske potentiale af stamcelleterapier kan realiseres. Den begrænsede kontrol over den chondrogene differentiering af stamceller in vivo har ofte resulteret i kompromitterede regenerative resultater. På grund af forekomsten af oxidativt stress og inflammation i mikromiljøet af skadesteder, gennemgår stamceller desuden ofte apoptose efter injektion.
For at løse disse udfordringer demonstrerede forskerne udviklingen af et 3D IHI nanoscaffold-skabelon stamcellesamlingssystem til avanceret 3D stamcellekultur og -implantation. 3D-IHI nanoscaffold samler hurtigt stamceller til injicerbare vævskonstruktioner gennem skræddersyede 3D-celle-celle- og celle-matrix-interaktioner, leverer dybt og homogent chondrogene proteiner i de samlede 3D-kultursystemer og inducerer kontrollerbart chondrogenese gennem nanotopografiske effekter.
Når først implanteret in vivo i en kaninbruskskademodel, modulerer 3D-IHI nanoscaffold effektivt dynamisk mikromiljø efter bruskskade gennem integrationen af de førnævnte regenerative signaler og fjerner samtidig reaktive oxygenarter ved hjælp af en mangandioxid-baseret sammensætning. På denne måde realiseres accelereret reparation af bruskdefekter med hurtig vævsrekonstruktion og funktionel genopretning både på kort og lang sigt. I betragtning af den fremragende alsidighed og terapeutiske resultat af 3D-IHI nanoscaffold-baseret bruskregenerering, kan det give lovende midler til at fremme en række vævstekniske applikationer.
Forskningen blev offentliggjort i National Science Review .
-
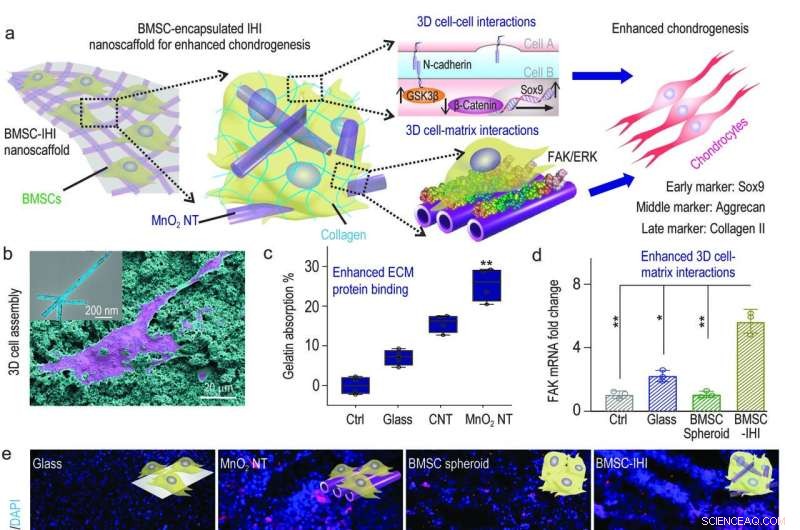
a) Et skematisk diagram, der viser 3D-IHI nanoscaffoldet, kunne forbedre chondrogen differentiering af BMSC gennem en synergi mellem N-cadherin og FAK-medierede veje. b) Det stærke samspil mellem MnO2 NTs and functional groups commonly existing in ECM proteins effectively supported cell attachment as demonstrated via SEM image. c) Bicinchoninic acid assay indicated the enhanced absorption toward gelatin from MnO2 nanotube compared to control groups. d) The MnO2 nanotube-templated assembly method significantly enhanced cell-matrix interaction as demonstrated through the up-regulated expression patterns of the FAK gene. e) Representative immunostaining images showing the improved chondrogenesis of BMSC in the BMSC-IHI nanoscaffold group compared to the control groups. Scale bar:50 μm. f-h) The expression of chondrogenic genes, including SOX9 (f), Aggrecan (g), and Col-II (h) were characterized via qRT-PCR measurement. Credit:Science China Press
-
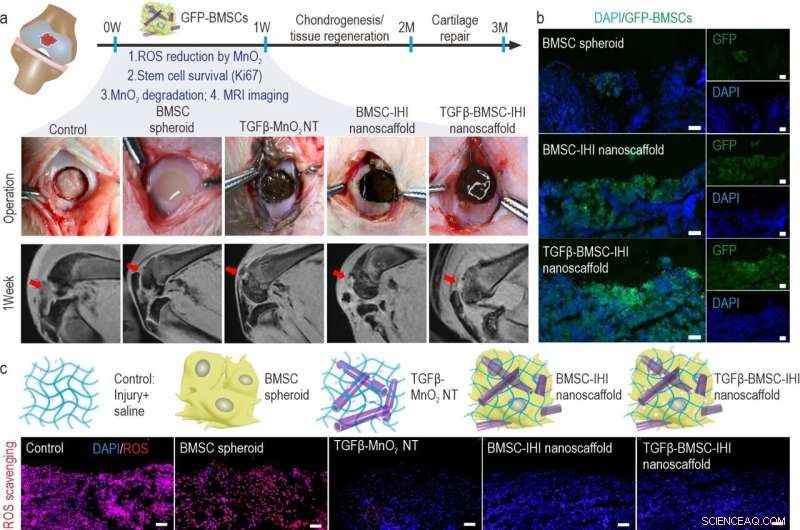
a) Schematic diagram illustrating the surgical process and timeline of cartilage repair. The degradation of MnO2 NTs and the regeneration process could be monitored via MRI. b) To identify our transplanted cells, BMSCs were genetically labeled with a green fluorescent protein (GFP). Scale bar:100 μm. c) The dramatically reduced red fluorescent signals of the ROS probe revealed that MnO2 NTs in the IHI nanoscaffold could effectively scavenge ROS in the defect area. Promoted cell proliferation was confirmed by the higher expression of proliferative marker Ki67 immunostaining. Scale bar:50 μm. d) The TGFβ-BMSC-IHI nanoscaffold could retain a significantly higher amount of cells after transplantation compared to other cell transplantation groups by quantifying the number of remaining GFP+ cells in (c). e) Histogram of the fluorescence intensity of ROS probe showed the effective consumption of ROS in the MnO2 NTs containing groups. f) Quantification of Ki67+ cells in the defects. The quantifications in (e) and (f) were generated based on the fluorescence intensities in (c). Credit:Science China Press
-
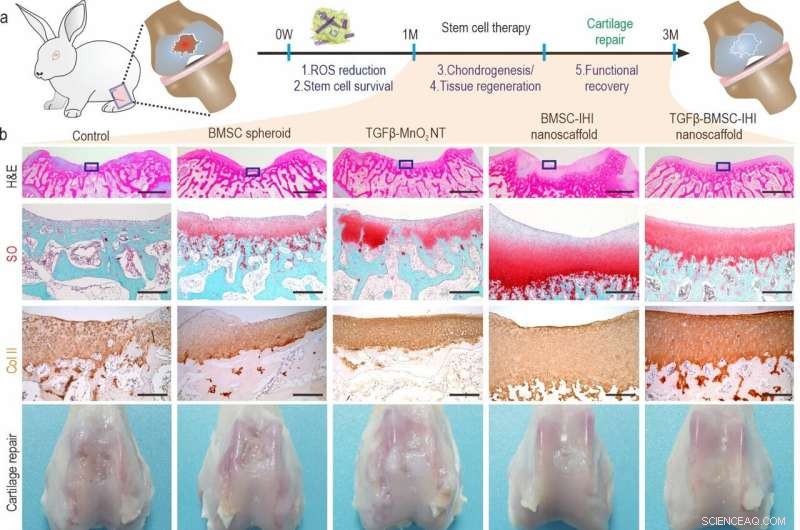
a) A schematic diagram illustrating the long-term (3 months) cartilage regeneration process. b) The in vivo cartilage regeneration was characterized through H&E, Safranin O staining, Col-II immunochemistry staining, as well as macroscopic views. Zoom out scale bar:2 mm, zoom in scale bar:200 μm. c-h) Quantifications of cartilage thickness (by H&E staining) (c), cellular components (by Safranin O staining) (d), ECM components (by Col II immunostaining) (e). Results of International Cartilage Repair Society (ICRS) macroscopic (f) and histologic scores (g) indicated significantly improved defect repair qualities in the TGFβ-BMSC-IHI nanoscaffold group. The reduced Osteoarthritis Research Society International (OARSI) scores revealed the TGFβ-BMSC-IHI nanoscaffold could prevent the deterioration of osteoarthritis (h). Credit:Science China Press
Discovery that TRPV4 gene regulates cartilage growth might yield future therapies for joint repair
 Varme artikler
Varme artikler
-
 Naturens værktøjssæt til at dræbe vira og bakterierKredit:Unsplash/CC0 Public Domain De sprang ud af toiletbobler, svømme over drikkevandet, spredes gennem hoste. Små infektiøse mikrober - fra virussen, der forårsager COVID-19, til vandbårne bakte
Naturens værktøjssæt til at dræbe vira og bakterierKredit:Unsplash/CC0 Public Domain De sprang ud af toiletbobler, svømme over drikkevandet, spredes gennem hoste. Små infektiøse mikrober - fra virussen, der forårsager COVID-19, til vandbårne bakte -
 Grafen / nanorør hybrid gavner fleksible solcellerEt flyvende tæppe holder nanorør på linje, efter at de er dyrket fra en grafenoverflade, som de er sømløst bundet til. Hybridmaterialet viste sig at være en effektiv katode til farvesensibiliserede so
Grafen / nanorør hybrid gavner fleksible solcellerEt flyvende tæppe holder nanorør på linje, efter at de er dyrket fra en grafenoverflade, som de er sømløst bundet til. Hybridmaterialet viste sig at være en effektiv katode til farvesensibiliserede so -
 Nyt medlem tilføjet til kulstofmaterialefamilien, en todimensionel monolag polymer fullerenStrukturen af monolag polymer C60. Kredit:Ella Maru Studio Syntetiske carbon allotroper er fascinerende for deres enestående egenskaber og potentielle anvendelser. Forskere har viet årtier til at
Nyt medlem tilføjet til kulstofmaterialefamilien, en todimensionel monolag polymer fullerenStrukturen af monolag polymer C60. Kredit:Ella Maru Studio Syntetiske carbon allotroper er fascinerende for deres enestående egenskaber og potentielle anvendelser. Forskere har viet årtier til at -
 Ny belægning til hofteimplantater kan forhindre for tidlig svigtHydroxyapatit-nanopartikler er inkorporeret i flerlagsbelægninger for hurtigere knoglevævsvækst. Billede udlånt af Hammond Lab Hvert år, mere end en million amerikanere modtager en kunstig hofte-
Ny belægning til hofteimplantater kan forhindre for tidlig svigtHydroxyapatit-nanopartikler er inkorporeret i flerlagsbelægninger for hurtigere knoglevævsvækst. Billede udlånt af Hammond Lab Hvert år, mere end en million amerikanere modtager en kunstig hofte-
- Hvordan man laver elektricitet med biogas
- Hvad gør et pattedyr til et pattedyr? Vores rygsøjle, siger videnskabsmænd
- Bliver vi snart uddød?
- Første open-access-data fra store kollider bekræfter subatomære partikelmønstre
- Sådan identificeres ru ædelsten
- Risikoen for tsunamier i Middelhavet er blevet overvurderet


