Enkle, billige, hurtige og præcise nanosensorer identificerer infektionssygdomme
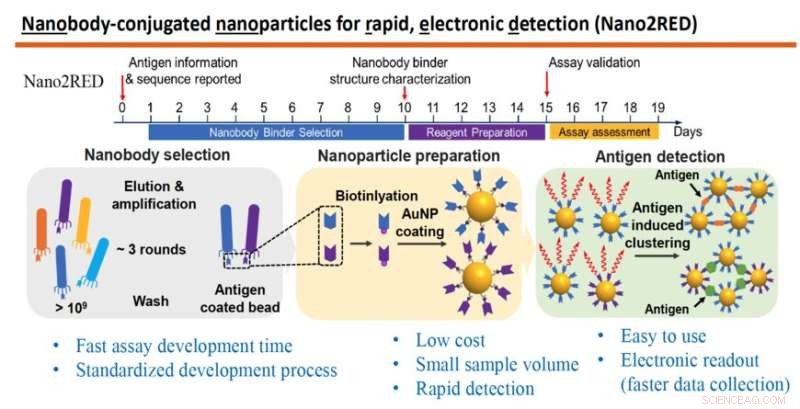
Grafikken fremhæver nøglefunktionerne i Nano2RED, en innovativ diagnostisk metode opfundet af professor Wang og hans kolleger. Den øverste sektion illustrerer den hurtige tidslinje for trin til produktion af testen, som alle kan udføres på cirka 20 dage. Den midterste del af grafikken viser de grundlæggende trin involveret. Først produceres og screenes et stort bibliotek af syntetiske antistoffer eller nanostoffer mod et kendt antigen (til venstre), derefter bliver nanostoffer knyttet til guldnanopartikler (midten), og til sidst påvises sygdomsantigener i en prøve, når guld-nanopartikelbundne nanostoffer smelter sammen med dem, hvilket giver et positivt testresultat (til højre). Kredit:Wang lab
I de senere år er dødelige infektionssygdomme, herunder ebola og COVID-19, dukket op for at forårsage omfattende menneskelig ødelæggelse. Selvom forskere har udviklet en række sofistikerede metoder til at opdage sådanne infektioner, står eksisterende diagnostik over for mange begrænsninger.
I en ny undersøgelse beskriver Chao Wang, en forsker ved Arizona State University's Biodesign Institute og School of Electrical, Computer &Energy Engineering, sammen med ASU-kolleger og samarbejdspartnere ved University of Washington (UW), Seattle en ny metode til påvisning af vira som f.eks. Ebola-virus (EBOV) og SARS CoV-2.
Teknikken, kendt som Nano2RED, er et smart twist på konventionelle højpræcisionstest, der er afhængige af komplekse testprotokoller og dyre udlæsningssystemer. Nanosensorerne i opløsning ("Nano2" i navnet) tjener til at påvise sygdomsantigener i en prøve ved simpel blanding. Den innovative hurtige og elektroniske udlæsningsproces ("RED") udviklet i Wang-laboratoriet leverer testresultater, som kan detekteres som en farveændring i prøveopløsningen, og registrerer dataene gennem billige halvlederelementer såsom LED'er og fotodetektorer.
Teknologien repræsenterer et betydeligt fremskridt i kampen mod infektionssygdomme. Det kan udvikles og produceres til meget lave omkostninger, implementeres inden for uger eller dage efter et udbrud og gøres tilgængeligt for omkring 1 cent pr. test.
Sammenlignet med almindeligt anvendte laboratorietests med høj nøjagtighed, såsom ELISA, er Nano2RED meget nemmere at bruge. Det kræver ikke overfladeinkubation eller vask, farvemærkning eller amplifikation, men giver stadig omkring 10 gange bedre følsomhed end ELISA. Derudover understøtter brugen af halvlederenheder et meget bærbart digitalt udlæsningssystem, som kan udvikles og produceres til en pris så lavt som et par dollars, hvilket gør det ideelt ikke kun til laboratoriebrug, men til klinikker, hjemmebrug og fjernbetjening eller ressourcekrævende steder. Denne tilgang er baseret på modulære designs og kan potentielt bruges til at teste for ethvert patogen.
"Denne teknologi virker ikke, fordi den er kompleks, men fordi den er enkel," siger professor Wang. "En anden unik egenskab er den tværfaglige karakter af biosensing. En grundlæggende forståelse af biokemi, fluidik og optoelektronik hjalp os med at finde på noget så 'simpelt'."
Wang er forsker ved Biodesign Center for Molecular Design and Biomimetics ved ASU. Han er også forsker ved ASU's School of Electrical, Computer and Energy Engineering; og Center for Fotonisk Innovation. Dr. Liangcai Gu er samarbejdspartner ved Institut for Biokemi og Institut for Proteindesign ved UW, Seattle.
Forskningen vises i det aktuelle nummer af tidsskriftet Biosensors and Bioelectronics . Dr. Xiahui Chen og Md Ashif Ikbal fra ASU og Dr. Shoukai Kang fra UW er de første forfattere, og Jiawei Zuo og Yuxin Pan er de andre bidragende forfattere.
Testflaskehalsen
Epidemiologer har længe kendt den grundlæggende formel, når de konfronteres med et sygdomsudbrud. For at identificere tilfælde og stoppe smitten er det nødvendigt at udvikle en nøjagtig test eller analyse, der kan identificere sygdommen, derefter teste tidligt og ofte for at vurdere spredningshastigheden og forsøge at isolere de inficerede.
Desværre, når en ny diagnostik er blevet udviklet, fremstillet og distribueret, er sygdomsudbruddet ofte allerede udbredt og udfordrende at begrænse. Yderligere er nøjagtige tests, herunder PCR (som kan forstærke bittesmå niveauer af patogene nukleinsyrer til målbare niveauer), ofte dyre, arbejdskrævende og kræver sofistikerede laboratoriefaciliteter.
Ebola-epidemien i 2014-2016, selvom den stort set var begrænset til Vestafrika, spredte sig med skræmmende hastighed, forårsagede panik og dræbte mere end 11.000 mennesker. Virussens dødelighedsrate, en af de højeste for et kendt patogen, kan overstige 90 %, afhængigt af sygdomsstammen. Krisen blev forværret af en kombination af utilstrækkelige overvågningssystemer og dårlig folkesundhedsinfrastruktur.
SARS CoV-2, selvom den er mindre dødelig end ebola, har spredt sig til alle lande på jorden og har allerede dræbt mere end 5,6 millioner mennesker verden over. I begge sygdomsudbrud ankom diagnostiske tests sent på stedet. Ydermere har dyre og besværlige testkrav betydet, at alt for få tests er blevet administreret, selv efter deres succesfulde udvikling.
Den nye undersøgelse anvender sin innovative metode til at teste for disse to fremtrædende sygdomme som et bevis på konceptet.
Flodbølge
Et fællestræk ved mange sygdomsudbrud er den lynhastighed, hvormed et patogen, der først har inficeret en håndfuld mennesker, kan samle momentum, vifte ud i alle retninger og hurtigt overvælde hospitaler og sundhedsudbydere. Cutting off a pathogen's routes of transmission requires identifying and isolating sick individuals through testing, as quickly as possible.
During a pandemic like COVID-19, the sensitivity of a given diagnostic test is secondary to how often the test is given and how long it takes for results to be processed. A highly sensitive test is of limited use if it can only be given once, and results require a weeks-long turnaround. Research has shown that infection outbreaks are best controlled when testing is repeated in less than 3-day intervals and at a large scale.
Adequately preparing society for current and future outbreaks of infectious disease will require faster, cheaper, more accurate and more easily usable diagnostics.
Close affinity
The new technology can identify secreted glycoprotein (sGP), a telltale fingerprint of Ebola virus disease and the SARS-CoV-2 spike protein receptor binding domain (RBD). The technology is highly accurate, rivaling ELISA, a long-recognized gold standard technology for diagnostic testing.
The basic idea of such diagnostics, known as immunoassays, is simple:A sample of blood (or other biological fluid) is applied to the assay, which is adorned with antibodies. When antibodies recognize the presence of a corresponding disease antigen in the sample, they bind with it, producing a positive test result. In the ELISA test, the disease antigen needs to be immobilized on a flat surface.
Nano2RED also relies on binding affinity for positive diagnosis but instead uses floating gold nanoparticles for readout. Unlike ELISA, Nano2RED can be developed from scratch in roughly 10 days and theoretically applicable for any pathogen, providing vitally important early surveillance in the case of a disease outbreak. It can deliver test results in 15-20 minutes and may be administered at an estimated cost of a penny per test. In the current study, the new test was shown to detect Ebola's sGP in serum with a sensitivity roughly 10 times better than ELISA.
Sensing danger
In this method, the first step is to produce a very large library containing over a billion random amino acid sequences, known as nanobodies, which can act as synthetic antibodies, able to bind with target disease antigens. This vast library of nanobodies is then successively screened against the antigen in question, for example, sGP in the case of Ebola. Only those nanobodies that show strong binding affinity for the antigen are used for sensing.
Next, the selected nanobodies are affixed to gold nanoparticles that will act as probes to identify and bind with antigens present in a blood sample. In the study, a pair of two high affinity nanobodies were selected and attached to gold nanoparticles. This approach improves both the sensitivity and specificity of the test.
The key innovation of Nano2RED is the way the antigen detection is registered. As disease antigens in the sample are recognized by the nanobodies, they bind together, forming clusters of bound nanobody and antigen, like islands of algae floating on the sea surface. "Basically, an antigen works like superglue to bring the nanoparticle together," Wang says.
A 'golden' opportunity in the fight against infectious disease
The gold nanoparticles provide a stable platform to hold the nanobodies in place. Once enough binding has taken place, the bound clusters begin to sink to the bottom of the vessel. This can be detected with the naked eye in the form of a color change. The solution becomes lighter in color as the gold-nanoparticle-carried antigen-antibody clusters precipitate out, signaling detection of the pathogen.
While full precipitation of nanoparticle clusters leading to a test result can normally take several hours, the process can be sped up by centrifuging the sample, which eliminates the wait time for precipitation. In this case, just 15-20 minutes are sufficient for a result. "Of course, the gold nanoparticles are heavy, and that helps quick sedimentation, too." Wang added.
Gold nanoparticles also work to display color, not yellow but red, by absorbing light from a narrow spectral range. This absorbance feature allowed the Wang lab to invent a tiny, inexpensive device that converts this color change into an electrical signal, using color-matching semiconductor LEDs and photodetectors. Such instruments produce a rapid and accurate readout of assay results, whose limits of detection are comparable to or better than costly lab-based spectroscopy methods.
The test also delivers quantitative results based on amount of antigen detected. This could be vitally useful for estimating disease severity as well as time elapsed since the infection event. In the future, the test results can be digitized by circuits and conveniently transmitted via internet to anywhere in the world for data analysis and further scrutiny, which could be important to government policy decision-making processes and timely interruption of the transmission.
Nano2RED requires only a tiny blood sample, typically around 20 microliters. "This also makes gold inexpensive in our case, because the mount we need is so tiny," Wang said. Unlike conventional methods, Nano2RED is also very simple to use with minimal training involved for healthcare personnel. It does not require any time-consuming and expensive incubation, washing, fluorescent labeling or amplification.
Future research will help improve the assay's limits of detection even further and modify its detection capacities to include virion particles, extracellular vesicles, small molecules, and nucleic acids.
"There is certainly still a lot to explore," Wang added, "but we so far have a happy marriage between engineering disciplines and biology. And that is what we will continue to work on." + Udforsk yderligere
Development of home COVID-19 test comparable to PCR accuracy, selectivity
 Varme artikler
Varme artikler
-
 Forskere identificerer nanopartikler, der kunne levere terapeutisk mRNA før fødslenKredit:CC0 Public Domain Forskere ved Childrens Hospital of Philadelphia og School of Engineering and Applied Science ved University of Pennsylvania har identificeret ioniserbare lipid-nanopartikl
Forskere identificerer nanopartikler, der kunne levere terapeutisk mRNA før fødslenKredit:CC0 Public Domain Forskere ved Childrens Hospital of Philadelphia og School of Engineering and Applied Science ved University of Pennsylvania har identificeret ioniserbare lipid-nanopartikl -
 Forskere producerer ensartede antimon-nanokrystaller til energilagringForskere fra Empa og ETH Zürich er for første gang lykkedes med at fremstille ensartede antimon-nanokrystaller. Testet som komponenter i laboratoriebatterier, disse er i stand til at opbevare et stort
Forskere producerer ensartede antimon-nanokrystaller til energilagringForskere fra Empa og ETH Zürich er for første gang lykkedes med at fremstille ensartede antimon-nanokrystaller. Testet som komponenter i laboratoriebatterier, disse er i stand til at opbevare et stort -
 Eksperiment og teori forenes endelig i debat om mikrobielle nanotrådeUMass Amherst-forskere siger, at de har afgjort striden mellem teoretiske og eksperimentelle forskere ved at udtænke en kombination af nye eksperimenter og bedre teoretisk modellering af specialisered
Eksperiment og teori forenes endelig i debat om mikrobielle nanotrådeUMass Amherst-forskere siger, at de har afgjort striden mellem teoretiske og eksperimentelle forskere ved at udtænke en kombination af nye eksperimenter og bedre teoretisk modellering af specialisered -
 Dødelig nanoparcel til kræftcellerElektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute De fleste tumorer indeholder områder med lav oxygenkoncentration, hvor cancerterapier baseret
Dødelig nanoparcel til kræftcellerElektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute De fleste tumorer indeholder områder med lav oxygenkoncentration, hvor cancerterapier baseret


