En ny teknik til isolering af intakte lysosomer fra cellekulturer
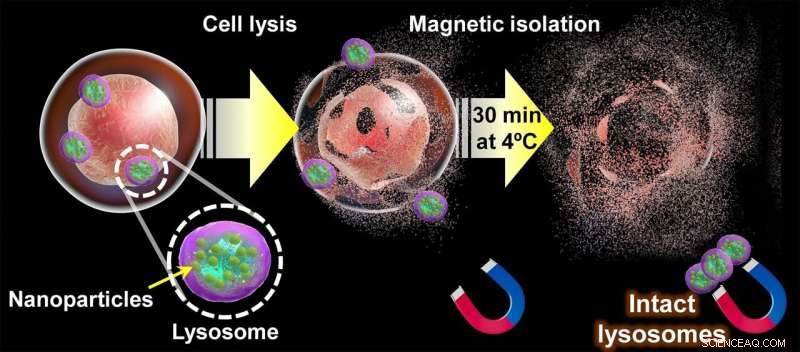
Diagram over den foreslåede tilgang til udvinding af intakte lysosomer. Når magnetiske nanopartikler naturligt har akkumuleret i en celles lysosomer gennem den endocytiske vej, er cellemembranen sprængt. og dets indhold "sigtet" i 30 minutter ved hjælp af magneter. Ved afslutningen af denne proces kan intakte lysosomer hentes fra magneterne og bruges til at studere deres struktur, metabolitter og proteinsammensætning. Kredit:Shinya Maenosono
Den korrekte funktion af celler hviler på den præcise orkestrering af mange komplekse processer og organeller. Lysosomer - vitale celleorganeller - er enzymfyldte underenheder, der findes i mange dyreceller, som hjælper med at nedbryde og genbruge makromolekyler, såsom proteiner, lipider og nukleotider. Udover deres funktion i cellulær fordøjelse og affaldshåndtering deltager lysosomer også i aminosyresignalering, som stimulerer proteinsyntese sammen med andre effekter.
I betragtning af, at mange sygdomme er forårsaget af defekter i lysosomfunktionen, er det ingen overraskelse, at forskere aktivt har forsøgt at forstå disse organeller i årtier. Men der er kun få teknikker, der tillader ekstraktion af lysosomer inde fra en celle. Den mest almindelige metode kaldes "densitetsgradient ultracentrifugering." Det involverer forsigtigt at bryde cellemembranen og påføre en centrifugalkraft på cellens indhold. Dette adskiller cellekomponenterne ved densitet. Desværre har nogle andre organeller samme tæthed som lysosomer, hvilket resulterer i prøver med urenheder. Desuden tager processen så lang tid, at mange lysosomale proteiner allerede er gået tabt og/eller nedbrudt, når den er færdig.
En mere avanceret teknik, kaldet "immunudfældning", er afhængig af at modificere lysosomers overfladeproteiner, så de kan fanges af magnetiske perler dækket af specielt skræddersyede antistoffer. Selvom denne tilgang giver renere resultater, modificeres proteinsammensætningen af de ekstraherede lysosomer ved proceduren, og efterfølgende proteinanalyser kan derfor kompromitteres. Det er derfor klart, at vi skal finde en bedre måde at udvinde lysosomer fra celler på.
Heldigvis har et team af videnskabsmænd ledet af Prof. Shinya Maenosono fra Japan Advanced Institute of Science and Technology (JAIST) gået op til pladen og udviklet en ny strategi til hurtigt at adskille intakte lysosomer med høj renhed. Denne undersøgelse blev offentliggjort i ACS Nano og inkluderede også prof. Kazuaki Matsumura og associeret prof. Yuichi Hiratsuka fra JAIST og prof. Tomohiko Taguchi fra Tohoku University, Japan.
Deres strategi er centreret omkring brugen af magnetisk-plasmoniske hybridnanopartikler (MPNP'er) lavet af sølv og en jern-koboltlegering og dækket af en forbindelse kaldet aminodextran (aDxt). Grundlaget for denne tilgang er, at de aDxt-dækkede MPNP'er naturligt indtages af cellerne gennem "endocytose", som kulminerer inde i lysosomer. Når nok MPNP'er har akkumuleret inde i lysosomerne, kan cellerne forsigtigt "knuses" og lysosomerne hentes ved hjælp af magneter.
For at denne metode skal fungere, er det vigtigt, at MPNP'er kun er placeret i lysosomer og ikke i andre organeller. Det er her, plasmon-billeddannelse er praktisk, da den særskilte måde, plasmoniske nanopartikler interagerer med lys, gør dem nemme at visualisere med et optisk mikroskop. Ved at farve hver type organel i den endocytiske vej forskelligt ved hjælp af immunfarvning og kontrollere, hvordan placeringen af MPNP'er overlapper med dem, bestemte forskerne den præcise tid, det tager de fleste MPNP'er at nå lysosomerne. Til gengæld sikrer dette, at separationsprocessen giver lysosomprøver med høj renhed.
Bagefter analyserede holdet virkningerne af temperatur og magnetisk separationstid på proteinsammensætningen af de ekstraherede lysosomer. Deres resultater viste, at proteintab var bemærkelsesværdigt hurtigt, selv ved temperaturer så lave som 4°C. Heldigvis var deres tilgang hurtig nok til at udvinde intakte lysosomer, som prof. Maenosono fremhæver:"Vi fandt ud af, at den maksimale tid, der krævedes for at isolere lysosomer efter cellebrud, var 30 minutter, hvilket er væsentligt kortere end den tid, der kræves ved brug af centrifugeringsbaserede teknikker, som typisk kræver en minimum adskillelsestid på flere timer."
Samlet set vil denne nye teknik hjælpe forskere med at udforske lysosomers skrøbelige metabolitter, og hvordan de ændrer sig som reaktion på stimuli. Til gengæld skal dette bane vejen for ny indsigt i lidelser relateret til lysosomal dysfunktion. I denne forbindelse bemærker prof. Maenosono:"I betragtning af lysosomes dybe relation til mange cellulære metabolitter er en dybere forståelse af lysosomal funktion nødvendig for at bestemme dens regulering i forskellige celletilstande. Derfor kan vores teknik bidrage til bedre forståelse og behandling af lysosomale sygdomme i fremtiden." Desuden kunne denne nye tilgang modificeres til at udvinde andre organeller udover lysosomer. Forhåbentlig vil denne undersøgelse bringe os tættere på at forstå indholdet af celler i langt højere grad. + Udforsk yderligere
Forskere udfører metabolomisk profilering af individuelle forstørrede lysosomer
 Varme artikler
Varme artikler
-
 Nanopartikel-jamming ved vand-olie-grænsefladenFastgørelse af NPer til tyndt befolket vand-olie-grænseflade. (A) Skematisk diagram, der viser fastgørelsen af en NP til den uberørte vand-olie-grænseflade. (B) Konfokale mikroskopibilleder, der vis
Nanopartikel-jamming ved vand-olie-grænsefladenFastgørelse af NPer til tyndt befolket vand-olie-grænseflade. (A) Skematisk diagram, der viser fastgørelsen af en NP til den uberørte vand-olie-grænseflade. (B) Konfokale mikroskopibilleder, der vis -
 Fluorescerende organiske nanopartikler overgår eksisterende metoder til langsigtet sporing af leven…Sporing af specifikke celler i normal udvikling og i sygdom er nu blevet lettere ved at bruge organiske fluorescerende kvanteprikker, som udviser betydelige fordele i forhold til eksisterende metoder.
Fluorescerende organiske nanopartikler overgår eksisterende metoder til langsigtet sporing af leven…Sporing af specifikke celler i normal udvikling og i sygdom er nu blevet lettere ved at bruge organiske fluorescerende kvanteprikker, som udviser betydelige fordele i forhold til eksisterende metoder. -
 Ingeniører finder en enkel, men smart måde at øge chiphastighederne påScanning tunneling microscopy (STM) billede af grafen på Ir(111). Billedstørrelsen er 15 nm × 15 nm. Kredit:ESRF En typisk computerchip indeholder millioner af transistorer forbundet med et omfatt
Ingeniører finder en enkel, men smart måde at øge chiphastighederne påScanning tunneling microscopy (STM) billede af grafen på Ir(111). Billedstørrelsen er 15 nm × 15 nm. Kredit:ESRF En typisk computerchip indeholder millioner af transistorer forbundet med et omfatt -
 Forskere kommer med en ny proces, der kan forbedre HD-tvForskere kommer med en ny proces, der kan forbedre HD -tv. Kredit:Queens University Belfast Forskere ved Queens University Belfast har arbejdet som en del af et internationalt team for at udvikle
Forskere kommer med en ny proces, der kan forbedre HD-tvForskere kommer med en ny proces, der kan forbedre HD -tv. Kredit:Queens University Belfast Forskere ved Queens University Belfast har arbejdet som en del af et internationalt team for at udvikle
- Billede:Falcon 9 -raket med Dragon -rumfartøj lodret ved Launch Complex 39A
- Camerouns eksploderende søer:Katastrofeekspert advarer om, at dødbringende gasudslip kan forårsag…
- Ny teknologi bryder igennem tegnsprogsbarrierer
- Trafikprop på Everest, da yderligere to klatrere dør ved at nå toppen
- Fremtidens bølge:Terahertz chipper en ny måde at gennemskue stof
- Sådan bestemmes relativ fugtighed ud fra et vådt og tørt pæretermometer


