Afkodning af proteinsamlingsdynamik med kunstige proteinnåle
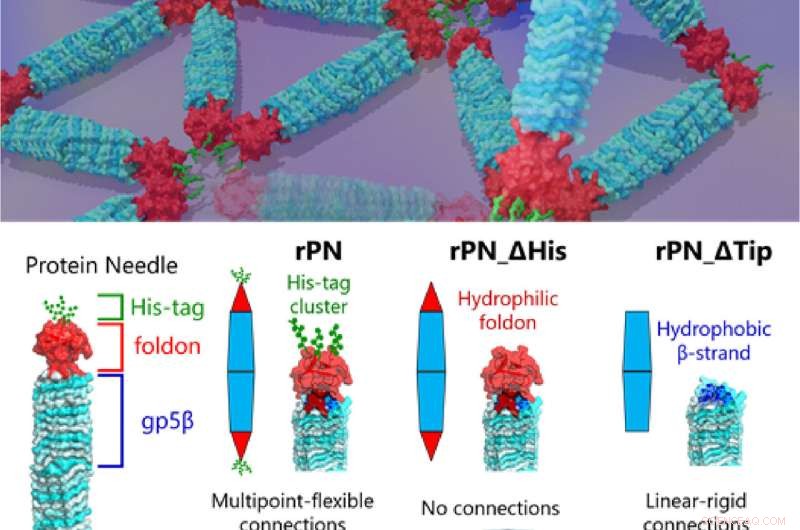
Fig. 1. Forskere har længe forsøgt at afkode proteiners komplekse understrukturer. Nu har forskere fra Tokyo Tech endelig kastet lys over denne front med undersøgelsen af manipuleret protein-selvsamling ved hjælp af proteinnåle. Kredit:Takafumi Ueno fra Tokyo Institute of Technology
Proteinsamling er afgørende for dannelsen af ordnede biologiske strukturer, men forestil dig at lave en. Det er præcis, hvad forskere ved Tokyo Tech nu har opnået med proteinnåle. Ved at regulere spids-til-spids-interaktionerne af disse nåle tillod de deres selvsamling i gitterstrukturer, ordnede monomere tilstande og fibersamlinger, hvilket banede vejen for den kontrollerede konstruktion af flere af sådanne proteinarkitekturer.
Proteiner er de grundlæggende byggesten i vores krop. Imidlertid er deres molekylære og makroskopiske strukturer komplekse og varierede med flere foldemønstre og understrukturer. Forskere har forsøgt at afkode disse strukturer i nogen tid, og der er gjort store fremskridt takket være fluorescensmikroskopi (FM), atomkraftmikroskopi (AFM) og højhastigheds-AFM (HS-AFM). De har dog ikke været i stand til direkte at observere proteiners dynamiske bevægelser under samling. Dette skyldes hovedsageligt den indviklede struktur af proteiner, som er for små til at kunne måles med eksisterende teknikker.
Et samarbejdende team af forskere fra Tokyo Institute of Technology (Tokyo Tech), Kyushu University, Nagoya University og National Institutes of Natural Sciences har nu udviklet en specialiseret anisotropisk proteinnål (PN) for at hjælpe med at bestemme samlingen af lignende anisotrope proteiner, hvilket giver os ledetråde om deres mikrostruktur og samling.
Prof. Takafumi Ueno fra Tokyo Tech, der ledede undersøgelsen, forklarer præmissen for deres arbejde, "Vores PN er et nåleformet protein sammensat af den stive krop (β-helix), den terminale hætte (foldon) og en binding motiv (hexa-histidin-tag, His-tag). Ved at modificere disse PN'er ved at slette His-tag-motivet og foldon-hætten kan vi producere tre forskellige typer PN'er. Dette gjorde os i stand til at regulere og observere forskellige samlingsmønstre, og hvordan de ændrer sig , hvilket giver os ledetråde til mekanikken bag forskellige protein-protein-interaktioner, som vi finder i naturen." Resultaterne af denne undersøgelse blev offentliggjort i tidsskriftet Small.
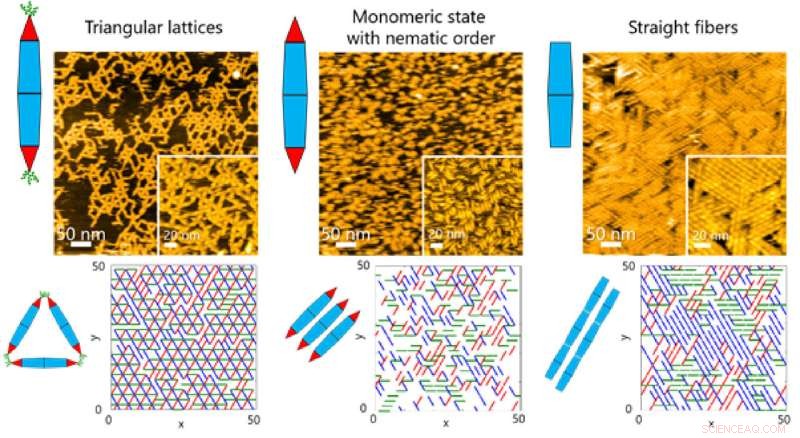
Fig. 2. Grundlæggende proteinkæder gennemgår ofte dynamisk selvsamling for at danne komplekse supramolekylære strukturer. Forskere ved Tokyo Tech har nu formået at udforske samlingsdynamikken ved hjælp af konstruerede proteinnåle. Kredit:Takafumi Ueno fra Tokyo Institute of Technology
I opløsning danner PN'erne spontant en meget stabil struktur med en længde på omkring 20 nm og en bredde på omkring 3,5 nm, lille nok til at spore rotationsbevægelsen af individuelle molekyler, men alligevel mekanisk stærk.
På overflader observerede holdet forskellige slags ordnede strukturer, da PN'erne var selvsamlede. Disse strukturer spændte fra trekantede gitter og monomere tilstande med nematisk orden (en-dimensionel orientering) til fibersamlinger (figur 1).
Dette gjorde det igen muligt for holdet at undersøge de dynamiske processer involveret i proteinsamling gennem en kombination af HS-AFM og simuleringer (figur 2). Resultaterne afslørede, at dannelsen af den trekantede gitterstruktur blev styret af de dynamiske bevægelser af PN, som bidrager til at danne ordnede gitter (figur 3).
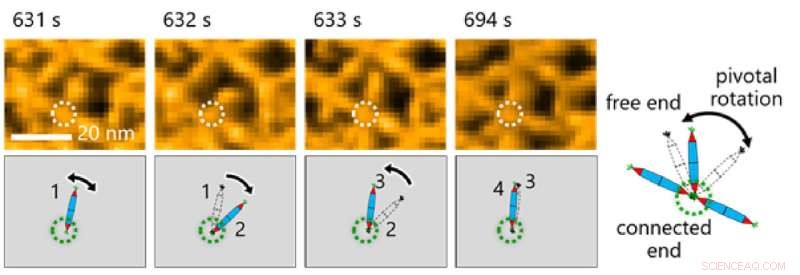
Fig. 3. Observation af PN'ernes molekylære bevægelse var afgørende for at foretage observationer i denne undersøgelse. Her bemærkede forskere pivotal rotation omkring His-tag-interaktionen mellem proteinnåle. Kredit:Takafumi Ueno fra Tokyo Institute of Technology
Disse resultater har begejstret forskerne, som overvejer dets potentielle konsekvenser. "Disse molekyler spiller en så afgørende rolle i biologiske systemer, at forståelse af deres struktur ville fremme feltet betydeligt. For eksempel kunne vi bruge dette til at lægge grunden til at konstruere supramolekylære strukturer ved at designe de dynamiske kollektive bevægelser af proteiner. Dette koncept kan føre til konstruktion af biokompatible pladematerialer, målrettede lægemiddeltransporter og endda proteinbaserede nanorobotter," siger prof. Ueno. + Udforsk yderligere
Kodning af hierarkiske samlingsveje for proteiner
 Varme artikler
Varme artikler
-
 Nano-imaging prober molekylær lidelseEn 3D-afbildning af de nyopdagede indeslutninger. De gule linjer repræsenterer spredningen af ladningsbærere ved inklusionsgrænser. Kredit:Christoph Hohmann, NIM Ved hjælp af en nyudviklet bille
Nano-imaging prober molekylær lidelseEn 3D-afbildning af de nyopdagede indeslutninger. De gule linjer repræsenterer spredningen af ladningsbærere ved inklusionsgrænser. Kredit:Christoph Hohmann, NIM Ved hjælp af en nyudviklet bille -
 Fysikere bruger nanostrukturer til at frigive fotoner til meget effektive hvide OLED'erPrincip for reaktiv ionætsning til frembringelse af kvasi-periodiske nanostrukturer. Kredit:(c) Sebastian Reineke et al., Naturkommunikation:CC BY 4.0 Takket være intensiv forskning i de sidste tr
Fysikere bruger nanostrukturer til at frigive fotoner til meget effektive hvide OLED'erPrincip for reaktiv ionætsning til frembringelse af kvasi-periodiske nanostrukturer. Kredit:(c) Sebastian Reineke et al., Naturkommunikation:CC BY 4.0 Takket være intensiv forskning i de sidste tr -
 Ny universel bæreblæk til 3D-printDet nye bæreblæk kan bruges til at fremstille personlige implantater såsom hjerteklapper. Kredit:Guzzi, et al. 2020 Forskere ved ETH har fremstillet en gel af cellulosefibre og biologisk nedbrydel
Ny universel bæreblæk til 3D-printDet nye bæreblæk kan bruges til at fremstille personlige implantater såsom hjerteklapper. Kredit:Guzzi, et al. 2020 Forskere ved ETH har fremstillet en gel af cellulosefibre og biologisk nedbrydel -
 Brug af kolloide nanodiske til 3D-bioprint af væv og vævsmodellerDr. Akhilesh K. Gaharwar, assisterende professor i Institut for Biomedicinsk Teknik, introducerede kolloide løsninger af 2D nanosilicater som en platformsteknologi til at printe komplekse strukturer v
Brug af kolloide nanodiske til 3D-bioprint af væv og vævsmodellerDr. Akhilesh K. Gaharwar, assisterende professor i Institut for Biomedicinsk Teknik, introducerede kolloide løsninger af 2D nanosilicater som en platformsteknologi til at printe komplekse strukturer v
- Undersøgelse afdækker udbredt lækagerisiko for amerikanske underjordiske brønde til lagring af n…
- Varme, luftfugtigheden holder fast i det østlige USA, mens weekenden går på
- Nyt materiale slår verdensrekord for at omdanne varme til elektricitet
- Gennembrud for nanomaterialer til printbare solceller
- Undersøgelse af tendenser inden for kunstig intelligens finder fremskridt i arbejdet med menneskeli…
- Sådan ser du bakterier under et microscope


