Fluorholdige lipopeptider fungerer som yderst effektive antibiotika til multiresistente patogener
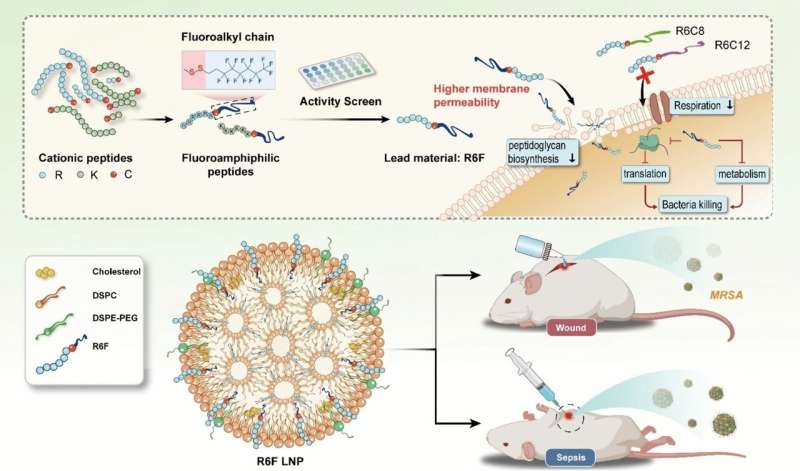
Multiresistente bakterieinfektioner, som ikke kan behandles med nogen kendt antibiotika, udgør en alvorlig global trussel. Udgivelse i tidsskriftet Angewandte Chemie International Edition , har et kinesisk forskerhold nu introduceret en metode til udvikling af nye antibiotika til at bekæmpe resistente patogener. Lægemidlerne er baseret på proteinbyggesten med fluorholdige lipidkæder.
Antibiotika ordineres ofte alt for let. I mange lande distribueres de uden recept og administreres i fabrikslandbrug:profylaktisk for at forhindre infektioner og forbedre ydeevnen. Som følge heraf er resistensen stigende - også i stigende grad mod reserve-antibiotika. Udviklingen af innovative alternativer er afgørende.
Det er muligt at lære noget af mikroberne selv. Lipoproteiner, små proteinmolekyler med fedtsyrekæder, er meget brugt af bakterier i deres kampe mod mikrobielle konkurrenter. En række lipoproteiner er allerede blevet godkendt til brug som lægemidler.
De fælles faktorer blandt de aktive lipoproteiner inkluderer en positiv ladning og en amfifil struktur, hvilket betyder, at de har segmenter, der afviser fedt og andre, der afviser vand. Dette giver dem mulighed for at binde sig til bakteriemembraner og trænge igennem dem til det indre.
Holdet ledet af Yiyun Cheng ved East China Normal University i Shanghai har til formål at forstærke denne effekt ved at erstatte brintatomer i lipidkæden med fluoratomer. Disse gør lipidkæden samtidigt vandafvisende (hydrofob) og fedtafvisende (lipofob). Deres særligt lave overfladeenergi styrker deres binding til cellemembraner, mens deres lipofobicitet forstyrrer membranens sammenhængskraft.
Holdet syntetiserede et spektrum (stofbibliotek) af fluorholdige lipopeptider fra fluorerede kulbrinter og peptidkæder. Til at forbinde de to stykker brugte de aminosyren cystein, som binder dem sammen via en disulfidbro.
Forskerne screenede molekylerne ved at teste deres aktivitet mod methicillin-resistente Staphylococcus aureus (MRSA), en udbredt, meget farlig bakteriestamme, der er resistent over for næsten alle antibiotika. Den mest effektive forbindelse, de fandt, var "R6F", et fluorholdigt lipopeptid lavet af seks argininenheder og en lipidkæde lavet af otte kulstof- og 13 fluoratomer. For at øge biokompatibiliteten blev R6F indesluttet i phospholipid nanopartikler.
I musemodeller blev R6F nanopartikler vist at være meget effektive mod sepsis og kroniske sårinfektioner med MRSA. Ingen toksiske bivirkninger blev observeret.
Nanopartiklerne ser ud til at angribe bakterierne på flere måder:de hæmmer syntesen af vigtige cellevægskomponenter, hvilket fremmer kollaps af væggene; de gennemborer også cellemembranen og destabiliserer den; forstyrre åndedrætskæden og stofskiftet; og øge oxidativt stress og samtidig forstyrre bakteriernes antioxidantforsvar.
I kombination dræber disse virkninger bakterierne - andre bakterier såvel som MRSA. Ingen resistens ser ud til at udvikle sig.
Disse indsigter giver udgangspunkt for udviklingen af højeffektive fluorholdige peptidlægemidler til behandling af multi-lægemiddelresistente bakterier.
Flere oplysninger: Jingjing Hu et al, A Fluorous Peptide Amphiphile with Potent Antimicrobial Activity for Treatment of MRSA-induced Sepsis and Chronic Wound Infection, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202403140
Journaloplysninger: Angewandte Chemie International Edition
Leveret af Wiley
 Varme artikler
Varme artikler
-
 Aflæsning af biologiske molekyler blev forbedret op til 100x ved at fordoble sensorerneKredit:Imperial College London Et koblet system af to miniaturedetektorer kaldet nanoporer forbedrer detektion af biologiske molekyler, herunder DNA og markører for tidlig sygdom. Evnen til at ko
Aflæsning af biologiske molekyler blev forbedret op til 100x ved at fordoble sensorerneKredit:Imperial College London Et koblet system af to miniaturedetektorer kaldet nanoporer forbedrer detektion af biologiske molekyler, herunder DNA og markører for tidlig sygdom. Evnen til at ko -
 Excitons vil forme fremtiden for elektroniske enhederKredit:EPFL Excitoner er kvasipartikler fremstillet af elektronernes exciterede tilstand og - ifølge forskning, der udføres EPFL - har potentialet til at øge energieffektiviteten af vores daglig
Excitons vil forme fremtiden for elektroniske enhederKredit:EPFL Excitoner er kvasipartikler fremstillet af elektronernes exciterede tilstand og - ifølge forskning, der udføres EPFL - har potentialet til at øge energieffektiviteten af vores daglig -
 Se væsker i nanoskala strømmeDenne kunstneriske gengivelse skildrer væskefyldte nanorør, der ændrer sig med tiden. Caltech-forskere brugte firedimensionel elektronmikroskopi til at visualisere og overvåge strømmen af smeltet bl
Se væsker i nanoskala strømmeDenne kunstneriske gengivelse skildrer væskefyldte nanorør, der ændrer sig med tiden. Caltech-forskere brugte firedimensionel elektronmikroskopi til at visualisere og overvåge strømmen af smeltet bl -
 Flere grupper hævder at skabe de første atomtykke siliciumpladerBillede af den todimensionelle bikagestruktur af silicen som fanget af et scanning tunneling mikroskop. Kredit:Guy Le Lay et al./TU Berlin (PhysOrg.com) -- Siden opdagelsen i 2004, grafen - plader
Flere grupper hævder at skabe de første atomtykke siliciumpladerBillede af den todimensionelle bikagestruktur af silicen som fanget af et scanning tunneling mikroskop. Kredit:Guy Le Lay et al./TU Berlin (PhysOrg.com) -- Siden opdagelsen i 2004, grafen - plader
- Energianalytiker foreslår at injicere kuldioxid i dybhavskløfter til permanent opbevaring
- Kraftig ny fotodetektor kan muliggøre optoelektroniske fremskridt
- DNA-analyser afslører hemmeligheder om stillehavsøstersen
- Sådan beregnes frekvensfaktoren i kemisk kinetik
- Rapport:Skodebrande truer Californiens fremskridt med at reducere drivhusgasser
- Kemikere syntetiserer psykotrope forbindelser fra regnskovstræ


