DNA-origami-baseret vaccineplatform forbedrer anti-tumor-responser gennem nanometer-præcis afstand mellem molekyler
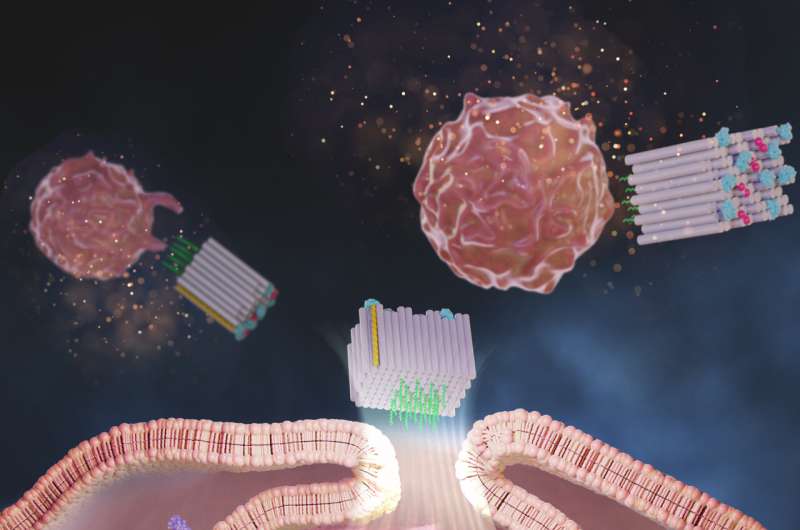
Terapeutiske kræftvacciner er en form for immunterapi under fremstilling, der ikke kun kan ødelægge kræftceller hos patienter, men også forhindre en kræftsygdom i at komme tilbage og sprede sig. Flere terapeutiske cancervacciner bliver undersøgt i kliniske forsøg, men på trods af deres løfte bliver de endnu ikke rutinemæssigt brugt af kliniske onkologer til at behandle deres patienter.
Den centrale ingrediens i terapeutiske cancervacciner er antigener, som fortrinsvis produceres eller nyproduceres (neoantigener) af tumorceller og gør det muligt for en patients immunsystem at søge og ødelægge kræftcellerne.
I de fleste tilfælde kan disse antigener ikke virke alene og har brug for hjælp fra adjuvansmolekyler, der udløser et generelt alarmsignal i immunceller kendt som antigen-præsenterende celler (APC'er). APC'er internaliserer både antigen- og adjuvansmolekyler og præsenterer antigenerne for forskellige typer T-celler. Disse T-celler lancerer derefter et øjeblikkeligt angreb mod tumoren eller bevarer en længerevarende hukommelse om tumoren til fremtidigt forsvar.
En cancervaccines effektivitet afhænger af niveauet og varigheden af den "alarm", dens adjuvanser kan ringe i APC'er. Tidligere har forskere fundet ud af, at levering af adjuvans- og antigenmolekyler til APC'er samtidig ved hjælp af nanostrukturer som DNA-origami kan øge APC-aktiveringen. Ingen af disse tilgange undersøgte imidlertid systematisk, hvordan antallet og nanoskala-arrangementet af adjuvansmolekyler påvirker nedstrøms tumorstyret immunitet.
Nu har et forskerhold ved Wyss Institute ved Harvard University, Dana-Farber Cancer Institute (DFCI), Harvard Medical School (HMS) og Korea Institute of Science and Technology (KIST) skabt en DNA-origami-platform kaldet DoriVac, hvis kerne komponent er en selvsamlende firkantet blokformet nanostruktur.
Til den ene flade af den firkantede blok kan definerede antal adjuvansmolekyler fastgøres i meget afstembare, nanopræcise mønstre, mens den modsatte flade kan binde tumorantigener. Undersøgelsen viste, at molekyler af en adjuvans kendt som CpG med en afstand på nøjagtig 3,5 nanometer fra hinanden resulterede i den mest gavnlige stimulering af APC'er, der inducerede en yderst ønskelig profil af T-celler, herunder dem, der dræber kræftceller (cytotoksiske T-celler), dem, der forårsager gavnlig inflammation (Th-1 polariserede T-celler), og dem, der giver en langsigtet immunhukommelse af tumoren (hukommelses-T-celler).
DoriVac-vacciner gjorde det muligt for tumorbærende mus bedre at kontrollere væksten af tumorer og overleve væsentligt længere end kontrolmus. Det er vigtigt, at virkningerne af DoriVac også synergiserede med virkningerne af immun checkpoint-hæmmere, som er en meget vellykket immunterapi, som allerede er meget brugt i klinikken. Resultaterne er offentliggjort i Nature Nanotechnology .
"DoriVacs DNA-origami-vaccineteknologi kombinerer forskellige nanoteknologiske egenskaber, som vi har udviklet gennem årene med en stadigt dybere viden om kræftundertrykkende immunprocesser," sagde Wyss Core Faculty-medlem William Shih, Ph.D., der ledede Wyss Institute-teamet sammen med førsteforfatter Yang (Claire) Zeng, M.D., Ph.D..
"Vi forestiller os, at antigener identificeret i patienter med forskellige typer tumorer i fremtiden hurtigt kunne indlæses på præfabrikeret, adjuvansholdig DNA-origami for at muliggøre yderst effektive personaliserede cancervacciner, der kan parres med FDA-godkendte checkpoint-hæmmere i kombinationsbehandlinger. "
Shih er også professor ved HMS og DFCI's afdeling for kræftbiologi og, som nogle af de andre forfattere, medlem af det tværinstitutionelle "Immuno-engineering to Improve Immunotherapy" (i3) Center baseret på Wyss.
Rationale for DNA-origami
CpG-adjuvansen er en syntetisk DNA-streng, der består af gentagne CpG-nukleotidmotiver, der efterligner det genetiske materiale fra immuncelle-invaderende bakterielle og virale patogener. Ligesom dets naturlige modstykker binder CpG-adjuvanser sig til en "farereceptor" kaldet TLR9 i immunceller, som igen inducerer en inflammatorisk (medfødt) immunrespons, der virker sammen med den antigen-inducerede (adaptive) immunrespons.
"Vi vidste fra tidligere arbejde, at for at udløse stærke inflammatoriske reaktioner, skal TLR9-receptorer dimerisere og aggregeres til multimere komplekser, der binder til flere CpG-molekyler. Nanoskalaafstandene mellem de CpG-bindende domæner i effektive TLR9-samlinger afsløret ved strukturel analyse faldt lige ind i række af det, vi antog, at vi kunne spejle med DNA-origami-strukturer, der præsenterer præcist fordelte CpG-molekyler," forklarede Zeng, som var instruktør i medicin på tidspunktet for undersøgelsen og nu er seniorforsker ved DFCI og Harvard Medical School (HMS).
Ud over Shih blev Zeng også vejledt på projektet af seniorforfatterne Ju Hee Ryu, Ph.D., en hovedforsker ved KIST, og Wyss Founding Core Faculty-medlem David Mooney, Ph.D., som også er professor ved Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS) og en af i3-centrets hovedefterforskere.
Zeng og teamet fremstillede DoriVac-vacciner, hvori forskellige antal CpG-strenge var placeret med en afstand på 2,5, 3,5, 5 eller 7 nanometer fra hinanden på den ene side af den firkantede blok, og et modelantigen blev knyttet til den modsatte flade. De beskyttede deres strukturer mod at blive nedbrudt i kroppen ved hjælp af en kemisk modifikationsmetode, som Shihs gruppe havde udviklet tidligere.
Når de blev internaliseret af forskellige typer APC'er, inklusive dendritiske celler (DC'er), som orkestrerer tumor-dirigeret T-celle-respons, forbedrede DoriVac-vaccinerne optagelsen af antigener sammenlignet med kontroller bestående af frie antigenmolekyler.
En CpG-afstand på 3,5 nanometer producerede de stærkeste og mest gavnlige reaktioner i APC'er og klarede sig betydeligt bedre end en kontrolvaccine, der kun indeholdt frie CpG-molekyler.
"Vi var glade for at finde ud af, at DoriVac-vaccinen fortrinsvis inducerede en immunaktiveringstilstand, der understøtter antitumorimmunitet, hvilket er, hvad forskere generelt ønsker at se i en god vaccine," sagde Zeng.
Udover afstanden har antallet af CpG-molekyler i DoriVac-vacciner også betydning. Holdet testede vacciner indeholdende mellem 12 og 63 optimalt fordelte CpG-molekyler og fandt ud af, at 18 CpG-molekyler gav den bedste APC-aktivering. Dette betød, at deres tilgang også kan hjælpe med at begrænse doseringen af CpG-molekyler og dermed minimere almindeligt observerede toksiske bivirkninger observeret med adjuvanser.
Fået i (tumor)oversættelse
Det er vigtigt, at disse in vitro-tendenser blev oversat til in vivo musetumormodeller. Når de blev injiceret profylaktisk under huden på mus, akkumulerede DoriVac-vacciner sig i de nærmeste lymfeknuder, hvor de stimulerede DC'er.
En vaccine fyldt med et melanomantigen forhindrede væksten af efterfølgende injicerede aggressive melanomceller. Mens alle kontroldyr var bukket under for kræften på dag 42 af forsøget, var DoriVac-beskyttede dyr alle i live.
DoriVac-vacciner hæmmede også tumorvækst hos mus, hvor dannelsen af melanom-tumorer allerede var i gang, med en 3,5 nanometer afstand på 18 CpG-molekyler, der igen gav maksimal effekt på DC- og T-celler, og den stærkeste reduktion i tumorvækst.
Dernæst spurgte holdet, om DoriVac-vacciner også kunne booste immunresponser produceret af små "neoantigener", der opstår i melanom-tumorer.
Neoantigener er ideelle mål, fordi de udelukkende er lavet af tumorceller. Imidlertid er de ofte ikke særlig immunogene i sig selv, hvilket gør højeffektive adjuvanser til en vigtig komponent i neoantigenvacciner. En DoriVac-vaccine tilpasset med fire neoantigener gjorde det muligt for forskerne i væsentlig grad at undertrykke væksten af tumoren i mus, der producerede neoantigener.
Til sidst spurgte forskerne, om DoriVac kunne synergi med immun checkpoint-terapi, som reaktiverer T-celler, der er blevet tavset i tumorer.
Hos mus resulterede de to terapier kombineret i total regression af melanom-tumorer og forhindrede dem i at vokse tilbage, når dyrene blev udsat for de samme tumorceller igen fire måneder senere. Dyrene havde opbygget en immunhukommelse af tumoren. Holdet opnåede en lignende vaccinationseffektivitet i en muselymfommodel.
"Vi mener, at DoriVac's værdi for at bestemme et sødt sted i adjuvans-tilførsel og forbedre leveringen og virkningerne af koblede antigener kan bane vejen for mere effektive kliniske cancervacciner til brug hos patienter med en række forskellige kræftformer," sagde Zeng.
Holdet er i øjeblikket ved at oversætte DoriVac-platformen til dens kliniske anvendelse, som understøttes af studiets vurdering af vaccinedistribution og vaccinestyrede antistoffer i mus, såvel som cytokiner produceret af immunceller som reaktion på vaccinerne in vivo.
"DoriVac-platformen er vores første eksempel på, hvordan vores stræben efter, hvad vi kalder Molecular Robotics - syntetiske bioinspirerede molekyler, der har programmerbar form og funktion - kan føre til helt nye og kraftfulde terapier. Denne teknologi åbner en helt ny vej for udvikling af designervacciner med egenskaber, der er skræddersyet til at imødekomme specifikke kliniske udfordringer. Vi håber at se dets hurtige oversættelse til klinikken," sagde Wyss Institutes stiftende direktør Donald Ingber, M.D., Ph.D.
Flere oplysninger: Yang C. Zeng et al., Finjustering af CpG rumlig fordeling med DNA-origami for forbedret cancervaccination, Nature Nanotechnology (2024). DOI:10.1038/s41565-024-01615-3
Leveret af Harvard University
 Varme artikler
Varme artikler
-
 Kasse med to låse leverer kræftbehandlingEn adeno-associeret viruscapsid (blå) modificeret af peptider (rød) indsat for at låse virussen er et resultat af forskning ved Rice University om en ny måde at målrette kræft- og andre syge celler. P
Kasse med to låse leverer kræftbehandlingEn adeno-associeret viruscapsid (blå) modificeret af peptider (rød) indsat for at låse virussen er et resultat af forskning ved Rice University om en ny måde at målrette kræft- og andre syge celler. P -
 Ny metode til at forbedre termisk ledningsevne kunne afkøle computerchips, lasere og andre enhederDette er et par bor -nanoribbons, der sidder sammen på en mikrodelen, der bruges til at måle varmeledningsevne. Kredit:Deyu Li Den overraskende opdagelse af en ny måde at tune og forbedre termisk
Ny metode til at forbedre termisk ledningsevne kunne afkøle computerchips, lasere og andre enhederDette er et par bor -nanoribbons, der sidder sammen på en mikrodelen, der bruges til at måle varmeledningsevne. Kredit:Deyu Li Den overraskende opdagelse af en ny måde at tune og forbedre termisk -
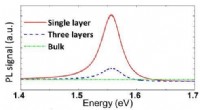 Ny todimensionel halvleder har ideel båndgab til solfangstSammenligning af fotoluminescens af forskellige tykkelser af molybdændiselenid. Enkeltlagsprøven har den højeste fotoluminescensværdi på grund af dens direkte båndgab. Billedkredit:Tongay, et al. ©201
Ny todimensionel halvleder har ideel båndgab til solfangstSammenligning af fotoluminescens af forskellige tykkelser af molybdændiselenid. Enkeltlagsprøven har den højeste fotoluminescensværdi på grund af dens direkte båndgab. Billedkredit:Tongay, et al. ©201 -
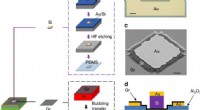 Forskere bygger en silicium-grafen-germanium-transistor til fremtidig THz-driftEnhedsdesign og fremstilling. en Si-Gr-Ge-transistor er bygget ved direkte at stable en Si-membran, enkeltlags grafen og et Ge-substrat. b Optisk billede af en Si–Gr–Ge-transistor (skalastang:20 μm).
Forskere bygger en silicium-grafen-germanium-transistor til fremtidig THz-driftEnhedsdesign og fremstilling. en Si-Gr-Ge-transistor er bygget ved direkte at stable en Si-membran, enkeltlags grafen og et Ge-substrat. b Optisk billede af en Si–Gr–Ge-transistor (skalastang:20 μm).
- Spredt galaksehob fundet fundet skjult for almindeligt syn
- Begrænsende faktorer for tempererede skove
- Forskere skaber bedre materiale til bærbare biosensorer
- Holder affaldet, hvor det hører hjemme:Kornstørrelsen forklarer, hvordan brugt nukleart brændsel …
- Overflade oxygenerede arter forbedrer kobolt-katalyseret Fischer-Tropsch-syntese
- Ny robot plukker et stykke peberfrugter og meget mere


