Brug af adavosertib-indkapslede MOF'er til p53-muteret galdeblærekræftbehandling via syntetisk dødelighed
Siden afsløringen af poly(ADP-ribose) polymerase (PARP)-hæmmere og deres bemærkelsesværdige resultater i behandlingen af BRCA1/2-mutante cancere, har syntetisk letalitet (SL) i antitumorterapi tiltrukket sig stigende opmærksomhed. SL er et fænomen, hvor en enkelt genetisk hændelse er utilstrækkelig til at inducere celledød, men flere genetiske hændelser fører til celledød.
Karakteriseringen af SL-genetiske interaktioner med tumorspecifikke mutationer kan bruges til at udvikle en begrebsramme til at tackle "undruggable" mål såsom tumorsuppressorgenet p53. Galdeblærekræft (GBC) er den mest udbredte ondartede tumor i galdesystemet og er typisk dødelig på grund af den begrænsede effekt af eksisterende behandling.
Det er blevet rapporteret, at p53 er et af de hyppigst muterede gener og en dårlig prognostisk markør i GBC. Derfor er en SL-baseret strategi til målretning mod p53-muteret GBC en lovende tilgang.
En ny undersøgelse om dette emne ledet af Prof. Mingyu Chen, Prof. Xiujun Cai, Dr. Shjie Li, Dr. Sarun Juengpanich og Dr. Win Topatana, alle fra Sir Run-Run Shaw Hospital, Zhejiang University, og Prof. Jicheng Yu fra College of Pharmaceutical Sciences, Zhejiang University optræder i Science Bulletin .
Tidligere undersøgelser har vist, at reparation af DNA-skade opnået af WEE1 gennem regulering af cellecyklus G2-kontrolpunkt er afgørende for overlevelsen af p53-muterede celler. Derfor har adavosertib (ADA), en WEE1-hæmmer, en signifikant syntetisk dødelig virkning på p53-muterede kræftformer. Men lægemiddelresistens på grund af DNA-skaderespons (DDR) kompensationsveje og høj toksicitet begrænser yderligere anvendelser.
Nylige undersøgelser har vist, at brugen af fysiske faktorer såsom fotodynamisk terapi (PDT), sonodynamisk terapi (SDT) og gasterapi i behandlingen af tumorer har overlegne virkninger og en bredere række af anvendelser end konventionelle kemiske lægemidler. Fysiske faktorer giver irreversible betingelser for at øge den syntetiske dødelige virkning af tumordrab, vil vise sig at være en effektiv strategi.
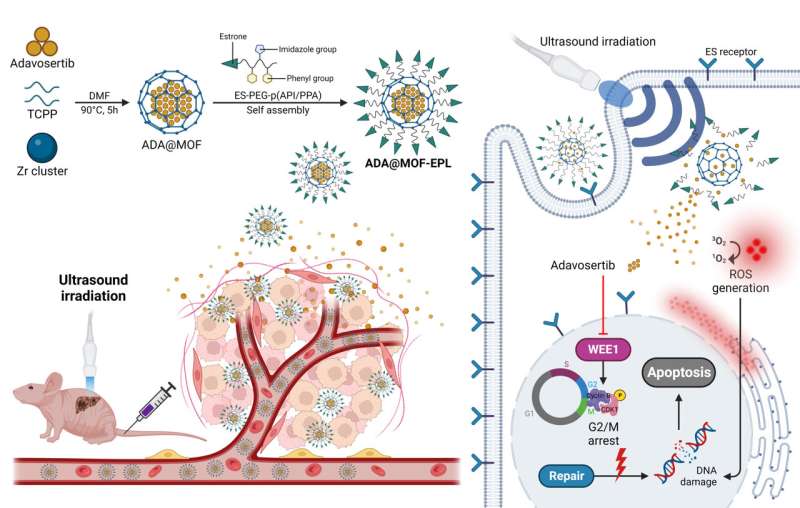
Baseret på MOF-strukturens evne til at realisere forskellige yderligere betingelser under levering af lægemidler, valgte denne nye undersøgelse MOF som et værktøj sammen med SDT til at øge den syntetiske dødelige effekt mellem WEE1 og p53 i GBC og opnåede et lovende resultat.
Specifikt blev en sonosensitiv porphyrin (tetrakis (4-carboxyphenyl) porphyrin, TCPP)-holdig Zr-MOF brugt som den organiske rygrad for sonodynamisk terapi (SDT), efterfulgt af ADA-indkapsling under one-pot MOF-syntesen for at øge ADA-belastningen af MOF'er (ADA@MOF). Ydermere blev overfladen af ADA@MOF coatet med pH-responsive østron-målrettede polymere ligander (EPL'er) for at give nanopartiklerne en tumor-målretningsevne (ADA@MOF-EPL).
På grund af den høje ekspression af østrogenreceptor (ER) i GBC, fungerer østron som en tumormålrettet ligand, der tillader nanopartikler hurtigt og præcist at komme ind og akkumulere nær cellekernen. Ved indtræden i det sure tumormikromiljø (TME), vil de svækkede ioniske interaktioner mellem ADA@MOF og EPL løsne dens struktur, hvilket fører til den første frigivelse af ADA.
Efterfølgende vil ultralydsbestråling (US) for at stimulere den sonosensitive porphyrinholdige MOF resultere i den accelererede frigivelse af ADA og generere ROS til beskadigelse af DNA. Dette vil forårsage en højere følsomhed af p53-muterede cancerceller over for ADA og undgå lægemiddelresistens på grund af DDR-kompensationsveje ved kilden.
Således ville den øgede syntetiske dødelige virkning mellem ADA og p53 gennem en yderligere tilstand af SDT have en robust tumor-dræbende evne. Derudover reducerer nanopartiklerne også i høj grad lægemidlets toksiske reaktion. Vigtigst er det, at denne nye undersøgelse tilbyder et nyt perspektiv på brugen af MOF-baserede lægemiddelleveringssystemer til behandling af forskellige refraktære kræftformer via forbedret SL.
Flere oplysninger: Shijie Li et al, Adavosertib-Encapsulated Metal-Organic Frameworks for p53-Mutated Galdeblære Cancer Treatment via Synthetic Lethality, Science Bulletin (2024). DOI:10.1016/j.scib.2024.02.039
Leveret af Science China Press
 Varme artikler
Varme artikler
-
 Neutraliserende antistoffer mod nye virarooke Harmon, en virolog hos Sandia, leder forskning for at opdage, designe og udvikle nye antistofmodforanstaltninger mod nye vira. Kredit:Sandia National Laboratories Forskere ved Sandia har skab
Neutraliserende antistoffer mod nye virarooke Harmon, en virolog hos Sandia, leder forskning for at opdage, designe og udvikle nye antistofmodforanstaltninger mod nye vira. Kredit:Sandia National Laboratories Forskere ved Sandia har skab -
 Kombination af grundstofferne palladium og ruthenium til industrienSyntese af strukturkontrollerede bimetalliske Pd-Ru nanopartikellegeringer. Kredit:Dongshuang Wu, Kohei Kusada, Hiroshi Kitagawa De kemiske grundstoffer palladium (Pd) og ruthenium (Ru) bruges beg
Kombination af grundstofferne palladium og ruthenium til industrienSyntese af strukturkontrollerede bimetalliske Pd-Ru nanopartikellegeringer. Kredit:Dongshuang Wu, Kohei Kusada, Hiroshi Kitagawa De kemiske grundstoffer palladium (Pd) og ruthenium (Ru) bruges beg -
 Kvanteprikker med uigennemtrængelig skal:Et kraftfuldt værktøj til nanoteknikBilleder af ZnO kvanteprikker udarbejdet af Institut for Fysisk Kemi ved det polske videnskabsakademi i Warszawa, taget ved transmissionselektronmikroskopi. Falske farver. Kredit:IPC PAS Unikke op
Kvanteprikker med uigennemtrængelig skal:Et kraftfuldt værktøj til nanoteknikBilleder af ZnO kvanteprikker udarbejdet af Institut for Fysisk Kemi ved det polske videnskabsakademi i Warszawa, taget ved transmissionselektronmikroskopi. Falske farver. Kredit:IPC PAS Unikke op -
 Små bobler:Behandling af astma med gendæmpende nanokapslerGrafisk abstrakt. Kredit:DOI:10.1021/acsnano.0c07781 Steroidbaserede inhalatorer leverer livreddende medicin til millioner af astmapatienter, giver lindring og evnen til blot at trække vejret. Des
Små bobler:Behandling af astma med gendæmpende nanokapslerGrafisk abstrakt. Kredit:DOI:10.1021/acsnano.0c07781 Steroidbaserede inhalatorer leverer livreddende medicin til millioner af astmapatienter, giver lindring og evnen til blot at trække vejret. Des
- Ny undersøgelse viser, at Amazonas laver sin egen regntid
- Hvorfor NZs cannabisregning skal forhindre industrien i at påvirke politik
- Undersøgelse for at forbedre datadrevet beslutningstagning for Shetlands akvakulturindustri
- Hjemmelavet Live Bird Trap Instructions
- Den kemiske sammensætning af udåndet luft fra humane lunger
- Studiet giver indsigt i, hvordan alger suger kuldioxid fra luften


