Nanomedicinsk forskning har til formål at transformere behandling af aortaaneurismer
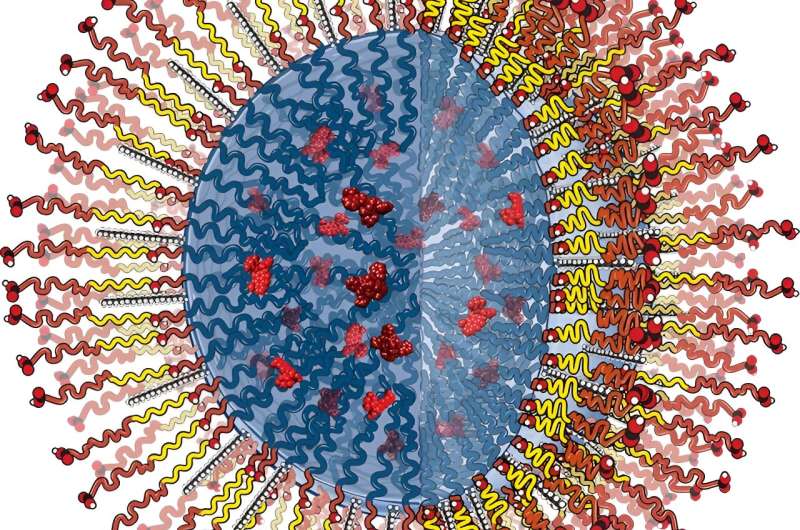
Aortaaneurismer er buler i aorta, det største blodkar, der transporterer iltrigt blod fra hjertet til resten af kroppen. Rygning, forhøjet blodtryk, diabetes eller skader kan alle øge risikoen for aneurismer, som har en tendens til at forekomme oftere hos kaukasiske mandlige rygere over 65 år.
"Det bløde væv, der udgør blodkarrene, fungerer i det væsentlige som gummibånd, og det er de elastiske fibre i disse væv, der gør det muligt for dem at strække sig og snappe tilbage," siger professor Anand Ramamurthi, formand for Institut for Bioteknik ved Lehigh University's P.C. Rossin College of Engineering and Applied Science.
"Disse fibre produceres primært før og lige efter fødslen. Herefter regenererer de ikke eller gennemgår naturlig reparation efter skade. Så når de bliver sårede eller syge, svækkes vævet og forårsager en aneurisme, som kan vokse over tid. Efter omkring syv til 10 år, når den typisk brudstadiet."
I den periode er der ingen behandling. Patienter screenes regelmæssigt via billeddiagnostik for at overvåge hastigheden af aneurismens vækst. Når først det anses for at være stort nok til potentielt at briste (en hændelse, der er dødelig 90 procent af tiden), er operation den eneste mulighed. Men det er risikabelt for ældre patienter.
Ramamurthi og hans team arbejder på minimalt invasive måder at regenerere og reparere disse elastiske fibre ved hjælp af polymere eller biologiske nanokapsler, kaldet nanopartikler, der er designet til at frigive nye regenerative terapier. Deres innovative teknikker kunne muliggøre behandling kort efter, at en aneurisme er opdaget og potentielt bremse, vende eller endda stoppe væksten.
Resultater fra deres seneste papir, offentliggjort i Journal of Biomedical Materials Research Part A , bygger videre på deres tidligere arbejde og repræsenterer et skridt mod en fremtid, hvor operation ikke længere er den bedste og eneste behandlingsmulighed.
"I tidligere forskning har vi identificeret lægemidler og gendæmpende midler, som faktisk kan lokke voksne syge vaskulære celler til at producere nye elastiske fibre og hæmme de enzymer, der nedbryder eksisterende fibre," siger han. "Vi har også arbejdet på, hvordan vi kun kan levere disse terapier effektivt på stedet for vævsreparation."
Holdet har også udviklet et nanopartikeldesign kaldet aktiv målretning, der inkorporerer små proteinfragmenter eller peptider på nanopartiklernes overflade. "Disse peptider genkender komponenter, der er unikke for aneurismevævet. Så når nanopartiklerne sprøjtes ind i blodbanen, klæber de kun til aneurismevæggen, hvor de langsomt nedbrydes og frigiver stoffet.
Til dette papir, siger han, har forskerne "undersøgt, hvordan nanopartiklerne rent faktisk trænger ind i blodkarvæggen for at levere lægemidlet til det berørte væv."
Alle blodkar er foret med en beskyttende barriere lavet af endotelceller, som kan blive "utæt", da betændelse fra vævsskade eller sygdom nedbryder endotelet og skaber mellemrum mellem cellerne. Disse huller tillader hvide blodlegemer at bevæge sig ind og starte vævsreparationsprocessen, og de tjener også som indgangspunktet for nanopartikler, der accelererer helingen.
"Vi ønskede at vide, hvordan formen og størrelsesforholdet af disse nanopartikler påvirker deres evne til at krydse den endotelcellebarriere," siger Ramamurthi.
Det var et kritisk spørgsmål at besvare, fordi ikke alle nanopartikler er skabt ens, og hvis de ikke kan trænge igennem barrieren, kan de ikke reparere vævet.
Ramamurthi og hans team udviklede en ny cellekulturmodel, hvor de simulerede sygdom og derefter undersøgte transportmekanismer, specifikt hvordan nanopartikler af forskellig art interagerede med endotelceller og bevægede sig gennem dem. Kom de ind gennem huller mellem endotelcellerne (en proces kaldet ekstravasation) eller gennem selve cellerne (det der er kendt som translokation)?
"Lad os sige, at en nanopartikel går gennem en endotelcelle. Noget af det forbliver måske i den celle og ikke kommer ud på den anden side, hvilket betyder, at du mister den partikel, og den er ikke længere nyttig for helingsprocessen. Målet er transport med minimal tilbageholdelse."
Holdet fandt ud af, at stavformede partikler, i modsætning til sfæriske partikler, med et højt aspektforhold (dvs. lange og tynde versus korte og stubbe) blev selektivt optaget af syge endotelceller. "Og de viste meget lidt optagelse i sunde endotelceller sammenlignet med sfærerne, hvilket er godt, fordi vi ikke ønsker, at de interagerer med sunde karvægge," siger han.
De fandt også, at partikler nåede vævet primært ved ekstravasation (eller via cellehullerne). "Jo længere og tyndere de var, jo mindre sandsynligt var det, at de ville forblive inden for endotelcellelaget, hvilket betyder, at de trænger igennem til det berørte væv for mere effektiv behandling."
Holdet vil nu integrere disse resultater med deres arbejde med aktiv målretning – inkorporerer komponenter på overfladen af nanopartikler, der genkender proteiner udtrykt af syge celler – i dyremodeller.
Det ultimative mål er at udvikle en ikke-kirurgisk regenerativ terapi, der er i stand til at bremse væksten af aneurisme. For eksempel at øge det nuværende vækst-til-brud-stadium fra syv år til 15 år. Et endnu mere ambitiøst resultat, siger Ramamurthi, ville være at vende den vækst tilbage.
"Regression af aneurismevækst ville være det foretrukne langsigtede resultat," siger han. "Det er langt væk, men vi er begejstrede, fordi disse resultater vil hjælpe os med at guide os til, hvordan vi designer vores nanopartikler til mere effektiv levering til aneurismevæggen. Det er en mulighed for at komme tættere på den virkelighed."
Flere oplysninger: Jimmy Yau et al., Vurdering af trans-endoteltransport af nanopartikler til levering til abdominale aortaaneurismer, Journal of Biomedical Materials Research Part A (2024). DOI:10.1002/jbm.a.37667
Leveret af Lehigh University
 Varme artikler
Varme artikler
-
 Små robotsvømmere, der helbreder sig selv fra skaderLille, Svømmerobotter kan magnetisk helbrede sig selv efter at være brækket i to eller tre stykker. Kredit:American Chemical Society Levende væv kan hele sig selv fra mange skader, men at give lig
Små robotsvømmere, der helbreder sig selv fra skaderLille, Svømmerobotter kan magnetisk helbrede sig selv efter at være brækket i to eller tre stykker. Kredit:American Chemical Society Levende væv kan hele sig selv fra mange skader, men at give lig -
 Små mikroorme kan implanteres under huden til kontinuerlig medicinsk overvågningEt scanningselektronmikroskopbillede viser et bundt af mikroorme produceret ved hjælp af en dampaflejringsproces udviklet af forskere ved MIT og Northeastern. Kredit:Gleason Lab Forskere ved MIT o
Små mikroorme kan implanteres under huden til kontinuerlig medicinsk overvågningEt scanningselektronmikroskopbillede viser et bundt af mikroorme produceret ved hjælp af en dampaflejringsproces udviklet af forskere ved MIT og Northeastern. Kredit:Gleason Lab Forskere ved MIT o -
 En ny skabelon til ikke -atmosfæriske virale nanokagerKredit:University of Twente I naturen, vira bruger nanokager til at beskytte deres genom. Nogle af disse vira kan skilles ad i proteinenheder for at fjerne deres genom. Disse proteinenheder kan de
En ny skabelon til ikke -atmosfæriske virale nanokagerKredit:University of Twente I naturen, vira bruger nanokager til at beskytte deres genom. Nogle af disse vira kan skilles ad i proteinenheder for at fjerne deres genom. Disse proteinenheder kan de -
 Seneste grafenforskning kan føre til forbedringer i bluetooth-headset og andre enhederAlexander Balandin, ret, og Guanxiong Liu, en af Balandins kandidatstuderende Forskere ved UC Riverside Bourns College of Engineering har bygget og med succes testet en forstærker lavet af grafe
Seneste grafenforskning kan føre til forbedringer i bluetooth-headset og andre enhederAlexander Balandin, ret, og Guanxiong Liu, en af Balandins kandidatstuderende Forskere ved UC Riverside Bourns College of Engineering har bygget og med succes testet en forstærker lavet af grafe
- Første ultra-lave tærskel kontinuerlig bølge lasing i GeSn
- Robert Bruce Merrifield
- Molybdænborid-keramik udviklet til SERS-detektion i barske omgivelser
- Facebook beder store banker om at dele kundeoplysninger
- Datamilepæl opnået i variabelt stjernelager
- Sikker, effektiv måde at producere brint fra aluminiumpartikler og vand til flyets energi


