Nanocarrier-forskning viser tumor-specifik lægemiddelfrigivelse gennem kontrolleret endosomal flugt
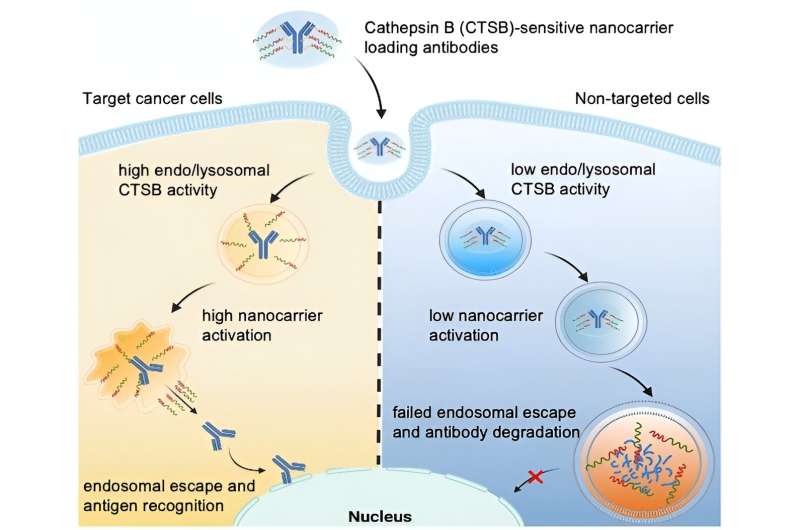
Proteinbaserede lægemidler skal transporteres ind i cellerne på en måde, der forhindrer deres øjeblikkelige nedbrydning. En ny tilgang skal sikre, at de kun forbliver intakte i visse celler, såsom kræftceller. I en undersøgelse offentliggjort i tidsskriftet Angewandte Chemie International Edition , har et japansk forskerhold introduceret en nanobærer, der kan "slippe" fra endosomer, før dens last bliver ødelagt der. Denne evne til at undslippe udløses kun i endosomerne af visse tumorceller.
Optagelsen af nanobærere i celler sker ved endocytose:Når en nanobærer lander på celleoverfladen, foldes cellemembranen ind og omslutter den i en boble, kaldet et endosom, som så driver ind i cellens indre. I sin sene fase smelter endosomet sammen med lysosomer, der indeholder enzymer, og danner et endolysosom. Inden for denne struktur nedbryder enzymerne både materiale fra kroppen og fremmedmateriale.
Et proteinbaseret lægemiddel kan kun blive aktivt, hvis det "undslipper" endolysosomet, inden det bliver nedbrudt. Dette er kendt som "endosomal flugt". Nogle nanobærere kan åbne den endo/lysosomale membran og dermed have endosomal undslippeevne.
Ledet af Kazunori Kataoka og Horacio Cabral sigter holdet på at tage dette et skridt videre ved at producere nanobærere, for hvilke endosomale escape kun udløses, når de kommer ind i meget specifikke celler, såsom tumorceller. Dette ville beskytte sunde celler. Forskerne udnytter det faktum, at forskellige typer celler har meget forskellige endolysosomale enzymaktiviteter. For eksempel er aktiviteten af proteasen cathepsin B (CTSB) særlig høj i cancerceller.
Med brugen af specielle fluorescensprobemolekyler studerede teamet fra Tokyo University og Kawasaki Institute of Industrial Promotion indledningsvis CTSB-aktivitet og proteinnedbrydning i endosomer. De fastslog, at i kræftceller med meget sure endosomer, er CTSB-aktivitet allerede meget høj i deres tidlige fase - betydeligt før proteinnedbrydningen stiger. Forskerne udnytter dette tidsvindue ved at bruge nanobærere, hvis endosomale flugtevne udløses af CTSB i kræftceller.
Holdet konstruerede poly(ethylenglycol)-baserede nanobærere med diaminoethangrupper, der er i stand til at "rive op" endo/lysosomale membraner. Ved hjælp af en linker vedhæftede de derefter antistoffer for at fungere som en model for et proteinlægemiddel. Nanobæreren afskærmer "rivningsværktøjerne", så de i starten er inaktive.
Linkeren er designet til at blive splittet af CTSB i endolysosomer. Dette adskiller lasten fra transportøren og aktiverer afrivningsværktøjerne. De åbner den endo/lysosomale membran og frigiver intakte antistoffer ind i cellens indre - men kun i tumorceller, der har forhøjet endosomal CTSB-aktivitet.
Denne metode kunne repræsentere en ny strategi for cellespecifik frigivelse af lægemidler gennem stimulus-responsive nanobærere med kontrolleret endosomal escape.
Flere oplysninger: Pengwen Chen et al., Selektiv intracellulær levering af antistoffer i kræftceller med nanobærere, der registrerer endo/lysosomal enzymaktivitet, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317817
Journaloplysninger: Angewandte Chemie International Edition
Leveret af Wiley
 Varme artikler
Varme artikler
-
 Polymer-grafen nanotæpper til at elektrificere smarte stofferSkemaet til at opnå en hybridstruktur af grafen-polymer. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytekniske Universitet, sammen med deres internationale kolleger, har opdaget en
Polymer-grafen nanotæpper til at elektrificere smarte stofferSkemaet til at opnå en hybridstruktur af grafen-polymer. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytekniske Universitet, sammen med deres internationale kolleger, har opdaget en -
 En effektiv strategi til beskyttelse af skyrmioner i kvantecomputereEn magnetisk skyrmion indespærret i en designet kanal i en ferromagnetisk film, hvor skyrmionen er beskyttet mod at blive rørt ved filmkanten. Kredit:Shinshu University En magnetisk skyrmion er et
En effektiv strategi til beskyttelse af skyrmioner i kvantecomputereEn magnetisk skyrmion indespærret i en designet kanal i en ferromagnetisk film, hvor skyrmionen er beskyttet mod at blive rørt ved filmkanten. Kredit:Shinshu University En magnetisk skyrmion er et -
 Nanokrystal selvsamling kaster af sig sine hemmelighederEt scanningselektronmikrografi af et nanokrystal-supergitter viser lang rækkefølge over store domæner. Kredit:Tisdale Lab Hemmeligheden bag et længe skjult magisk trick bag selvsamlingen af nano
Nanokrystal selvsamling kaster af sig sine hemmelighederEt scanningselektronmikrografi af et nanokrystal-supergitter viser lang rækkefølge over store domæner. Kredit:Tisdale Lab Hemmeligheden bag et længe skjult magisk trick bag selvsamlingen af nano -
 Nanopartikler giver indsigt i interaktioner mellem enkeltstrenget DNA og deres bindingsproteinerSkematisk illustration, der viser den mekanisme, der bruges til at probe interaktioner mellem enkeltstrenget DNA (ssDNA) og enkeltstrenget DNA-bindende protein (SSB). Kredit:2011 ACS Dobbeltstreng
Nanopartikler giver indsigt i interaktioner mellem enkeltstrenget DNA og deres bindingsproteinerSkematisk illustration, der viser den mekanisme, der bruges til at probe interaktioner mellem enkeltstrenget DNA (ssDNA) og enkeltstrenget DNA-bindende protein (SSB). Kredit:2011 ACS Dobbeltstreng
- Forskelle mellem konceptuelle uafhængige variabler og operationelle uafhængige variabler
- Embedsmænd vil have 100 millioner dollars til restaurering af rev i Florida Keys
- At bygge chips fra kollapsende nanopiller
- H2 Power, opstart af brintbrændstof, licenserer ny formel fra Army Research Lab
- Nord Streams metanlækage kan være den største nogensinde i atmosfæren
- Robotisk samling af verdens mindste hus - selv en mide passer ikke ind ad døren


