Beyond celler:Afsløring af potentialet i genetiske kredsløb på enkelte DNA-molekyler
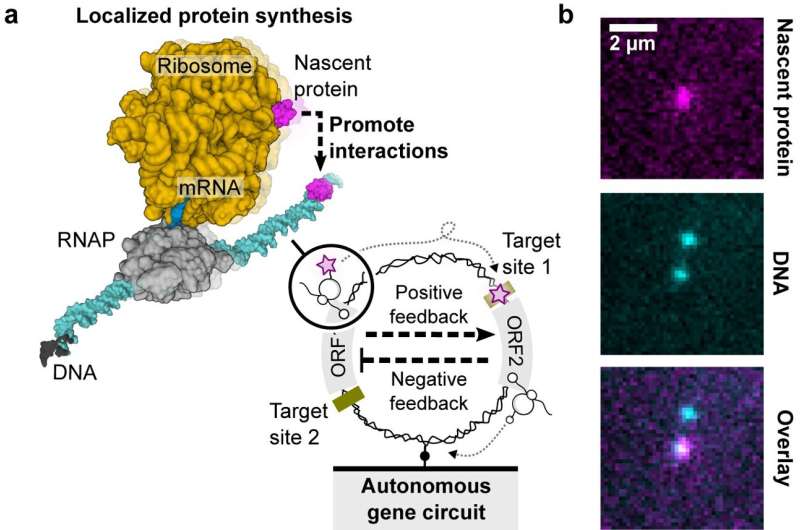
I en ny Nature Communications undersøgelse har forskere udforsket konstruktionen af genetiske kredsløb på enkelte DNA-molekyler, og demonstreret lokaliseret proteinsyntese som et vejledende princip for dissipative nanoenheder, der giver indsigt i kunstigt celledesign og nanobioteknologiske anvendelser.
Udtrykket "genetisk kredsløb" er en metaforisk beskrivelse af det komplekse netværk af genetiske elementer (såsom gener, promotorer og regulatoriske proteiner) i en celle, der interagerer for at kontrollere genekspression og cellulære funktioner.
Inden for kunstig celledesign sigter forskerne efter at replikere og konstruere disse genetiske kredsløb for at skabe funktionelle, selvstændige enheder. Disse kredsløb fungerer som det molekylære maskineri, der er ansvarligt for at orkestrere cellulære processer ved præcist at regulere produktionen af proteiner og andre molekyler.
Ved at forstå og manipulere disse kredsløb kan forskere konstruere kunstige celler med programmerbar adfærd, der efterligner naturlige cellers funktionaliteter.
I forbindelse med det nævnte studie er der fokus på at konstruere genetiske kredsløb på enkelte DNA-molekyler. Dette repræsenterer en ny tilgang, da den bevæger sig væk fra den traditionelle cellulære kontekst og undersøger muligheden for at skabe genetiske kredsløb under cellefrie forhold.
Førsteforfatter Dr. Ferdinand Greiss fra Weizmann Institute of Science i Israel forklarede forskernes motivation til Phys.org:"Vi forsøger at rekonstruere biologiske processer uden for det komplekse kredsløb af levende celler og forhåbentlig forbedre vores forståelse af naturens vejledende principper. forskning er rettet mod konstruktion af fremtidige kunstige celler, og enkelte DNA-molekyler kunne være det genetiske grundlag for sådanne."
Genregulering
Genregulering er den proces, hvorved celler styrer ekspressionen af gener, der bestemmer, hvornår og i hvilket omfang et gens information bliver brugt i syntesen af funktionelle molekyler som proteiner eller RNA. Det spiller en afgørende rolle i at opretholde cellulære funktioner, reagere på miljøændringer og sikre korrekt udvikling.
Reguleringen af genekspression involverer transkription og translation. Under transkription tjener et specifikt segment af DNA som en skabelon for syntesen af komplementære mRNA-molekyler med RNA-polymerase. Dette mRNA bærer den genetiske kode fra kernen til cytoplasmaet, hvor translationen finder sted.
Translation involverer omdannelse af mRNA til proteiner. Ribosomer læser mRNA-sekvensen, hvilket letter samlingen af aminosyrer til en polypeptidkæde, der danner proteinet kodet af genet.
"I prokaryote systemer er transkriptions- og translationsprocesserne koblet. Det betyder, at når først RNA-polymerasen producerer mRNA fra DNA, kan ribosomet finde det ribosomale bindingssted på det spirende mRNA for at begynde at syntetisere proteinet. Det spirende protein kan foldes og fungere. mens det stadig er bundet til DNA'et af RNA-polymerase-mRNA-ribosomkomplekset Efter afbrydelse af enten transkription eller translation, falder det begyndende protein af DNA'et og spredes i masseopløsningen," forklarede medforfatter Dr. Shirley Shulman Daube. Weizmann Institute of Science i Israel.
Betydningen ligger i den øgede lokale koncentration af begyndende proteiner, som er omkring 1.000 gange højere end den omgivende bulk-opløsning. Denne rumlige organisation og koncentrationsboost kunne have konsekvenser for cellulære funktioner og potentielt spille en rolle i konstruktionen af kunstige celler ved hjælp af enkelte DNA-molekyler.
Opbygning af et genetisk kredsløb på et enkelt DNA-molekyle
"Genetiske kredsløb er baseret på genetisk kodede molekyler, såsom transkriptionsfaktorer, der produceres fra DNA og binder tilbage til DNA'et for at regulere deres egen og andre molekylers produktion," siger medforfatter Dr. Vincent Noireaux fra University of Minnesota .
For at bygge det genetiske kredsløb på et enkelt DNA-molekyle designede forskerne specifikke sekvenser med lambdabakteriofaggener (E. coli).
Det genetiske kredsløb involverede en negativ kaskade, styret af CI-repressorgenet og dets operatørbindingssted, som kompliceret kontrollerer HT-genet. Dette HT-gen kodede for HaloTag-proteinet (HT), et afgørende element til at visualisere begyndende proteiner på individuelle DNA-molekyler.
Undersøgelsen implementerede stringente betingelser, herunder lav DNA-overfladetæthed, for at sikre præcis lokaliseret proteinsyntese.
Samtidig udfoldede en positiv kaskade sig med fusionen af T7-bakteriofag-RNA-polymerase (HT-T7 RNAP) og HT-proteinet, hvilket muliggjorde realtidsovervågning af genekspression gennem et downstream-reportergen, GFP.
Et langt rødt fluorogent farvestof (MaP655-Halo) forbedrede påvisningen af nyopståede proteiner og gav et omfattende overblik over det genetiske kredsløbs dynamik.
Den negative kaskade, eller undertrykkelse, regulerer og hæmmer produktionen af specifikke proteiner under visse betingelser. På den anden side bidrager positive kaskader til aktivering og ekspression af specifikke gener i det genetiske kredsløb.
Forskningen gik ud over blot observation og inkorporerede et feedback-kredsløb med en syntetisk dCro-repressor. Denne komponent var afgørende for at regulere genekspression gennem en omhyggeligt designet syntetisk promotor.
Fri for cellulær indeslutning
Forskerne opdagede, at lokaliseret proteinsyntese på et enkelt DNA-molekyle kan drive genetiske kredsløb under cellefrie forhold uden indespærring af cellulære rum. Dynamikken i genetiske kredsløb blev omhyggeligt observeret under meget fortyndede forhold.
Hovedforfatter Dr. Roy Bar-Ziv fra Weizmann Institute of Science i Israel fremhævede betydningen af deres resultater:"Reguleringen af genekspression afhænger af proteiner, der binder til DNA'et, blokerer eller øger aktiviteten af et gen. Bindingen kræver høj koncentrationer af proteiner til at finde og binde specifikke sekvenser på DNA-molekylet Uventet finder vi, at lokaliseret proteinsyntese forbigående kan øge koncentrationen længe nok til, at proteiner kan gøre det samme uden cellulær indeslutning."
Fundet udfordrer i bund og grund den konventionelle opfattelse af, at høje koncentrationer er afgørende for genregulering, og introducerer et nyt aspekt af lokaliseret proteinsyntese som et middel til at påvirke genetiske kredsløb under cellefrie forhold.
Til fremtidigt arbejde forestiller forskerne sig at udnytte lokaliseret proteinsyntese som et vejledende princip for at forbedre funktionaliteten af kunstige celler konstrueret af enkelt DNA-molekyler, der løser udfordringer ved lave koncentrationer. De forudser også potentielle anvendelser i selvkodede nanoenheder og planlægger at udforske sammenhænge mellem DNA-struktur, genekspressionsdynamik og proteinsyntese.
Forskningen involverede også bidrag fra Nicolas Lardon med prof. Kai Johnsson ved MPI for Medical Research, som udviklede det fluorogene farvestof (MaP655-Halo); Yoav Barak, der hjalp med at optimere DNA-præparatet; og Leonie Schütz sammen med prof. Elmar Weinhold, der var pionerer i udviklingen af methyltransferaser til stedspecifikke DNA-modifikationer med biotiner.
Flere oplysninger: Ferdinand Greiss et al., Et genetisk kredsløb på et enkelt DNA-molekyle som en autonom dissipativ nanoenhed, Nature Communications (2024). DOI:10.1038/s41467-024-45186-2
Journaloplysninger: Nature Communications
© 2024 Science X Network
 Varme artikler
Varme artikler
-
 Undersøgelse finder, at overfladetekstur af galliumnitrid påvirker celleadfærdKredit:North Carolina State University Forskere ved North Carolina State University har fastslået, at overfladeteksturen af galliumnitrid (GaN) materialer kan påvirke sundheden for nærliggende c
Undersøgelse finder, at overfladetekstur af galliumnitrid påvirker celleadfærdKredit:North Carolina State University Forskere ved North Carolina State University har fastslået, at overfladeteksturen af galliumnitrid (GaN) materialer kan påvirke sundheden for nærliggende c -
 Brug af nanoteknologi til at øge levetiden for medicinske implantaterProfessor Leon Shaw med en kandidatstuderende i sit laboratorium på Institute of Materials Science. Foto af Peter Morenus (PhysOrg.com) -- UConns ingeniørforskere er ved at udvikle en ny familie a
Brug af nanoteknologi til at øge levetiden for medicinske implantaterProfessor Leon Shaw med en kandidatstuderende i sit laboratorium på Institute of Materials Science. Foto af Peter Morenus (PhysOrg.com) -- UConns ingeniørforskere er ved at udvikle en ny familie a -
 Kobber, men ikke sølv, er effektiv mod SARS-CoV-2 på overfladerMaterialet en overflade er lavet af påvirker, hvor længe vira og bakterier kan forblive smitsom på den. Kredit:RUB, Marquard Som følge af korrosion frigiver kobber og sølv positivt ladede ioner til
Kobber, men ikke sølv, er effektiv mod SARS-CoV-2 på overfladerMaterialet en overflade er lavet af påvirker, hvor længe vira og bakterier kan forblive smitsom på den. Kredit:RUB, Marquard Som følge af korrosion frigiver kobber og sølv positivt ladede ioner til -
 Forskere udvikler nyt værktøj til undersøgelse af rumlige mønstre i levende cellerGuld nanopartikler i en lipidmembran kan kobles til biomolekyler til undersøgelse af specifikke cellulære funktioner. Her er guldnanopartikler blevet koblet til biotin (vitamin B7), som spiller en væs
Forskere udvikler nyt værktøj til undersøgelse af rumlige mønstre i levende cellerGuld nanopartikler i en lipidmembran kan kobles til biomolekyler til undersøgelse af specifikke cellulære funktioner. Her er guldnanopartikler blevet koblet til biotin (vitamin B7), som spiller en væs
- COVID-19 er en generalprøve for iværksættertilgang til klimaændringer
- Er Californiens blackouts det nye normale for staten?
- Kan Twitter ændre sin 'kerne' og forblive Twitter?
- Calciumforbindelsen går i stykker som frastøder som regel
- Kunstig intelligens for bedre computergrafik
- Australiere får færre børn, og den lokalfødte befolkning er ved at skrumpe:Hvorfor er det ikke s…


