Dekorerede nanopartikler forhindrer anafylaksi uden at forårsage bivirkninger i museundersøgelse
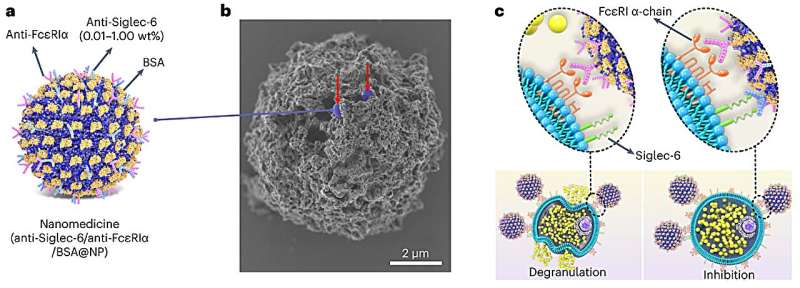
Northwestern University-forskere har udviklet den første selektive terapi til at forhindre allergiske reaktioner, som kan variere i sværhedsgrad fra kløende nældefeber og rindende øjne til vejrtrækningsbesvær og endda død.
For at udvikle den nye terapi dekorerede forskere nanopartikler med antistoffer, der er i stand til at lukke ned for specifikke immunceller (kaldet mastceller), der er ansvarlige for allergiske reaktioner. Nanopartiklerne bærer også et allergen, der svarer til patientens specifikke allergi. Hvis en person er allergisk over for f.eks. jordnødder, så bærer nanopartiklerne et jordnøddeprotein.
I denne to-trins tilgang engagerer allergenet de præcise mastceller, der er ansvarlige for den specifikke allergi, og derefter lukker antistofferne kun disse celler. Denne meget målrettede tilgang gør det muligt for terapien selektivt at forebygge specifikke allergier uden at undertrykke hele immunsystemet.
I en museundersøgelse viste terapien 100 % succes med at forhindre allergiske reaktioner uden at forårsage mærkbare bivirkninger.
Forskningen er offentliggjort i dag (16. januar) i tidsskriftet Nature Nanotechnology . Det markerer den første nanoterapi til hæmning af mastceller og forhindrer dermed en allergisk reaktion på et specifikt allergen.
"I øjeblikket er der ingen tilgængelige metoder til specifikt at målrette mod mastceller," sagde Northwesterns Evan A. Scott, der ledede undersøgelsen. "Alt, hvad vi har, er medicin som antihistaminer til at behandle symptomer, og de forhindrer ikke allergier. De modvirker virkningerne af histaminer, efter at mastcellerne allerede er blevet aktiveret."
"Hvis vi havde en måde at inaktivere de mastceller, der reagerer på specifikke allergener, så kunne vi stoppe farlige immunreaktioner i alvorlige situationer som anafylaksi såvel som mindre alvorlige reaktioner som sæsonbestemte allergier."
"Det største udækkede behov er anafylaksi, som kan være livstruende," sagde Northwesterns Dr. Bruce Bochner, allergiekspert og medforfatter af undersøgelsen. "Visse former for oral immunterapi kan være nyttige i nogle tilfælde, men vi har i øjeblikket ikke nogen FDA-godkendte behandlingsmuligheder, der konsekvent forhindrer sådanne reaktioner bortset fra at undgå den fornærmende mad eller agent. Ellers gives behandlinger som adrenalin til behandling af alvorlige reaktioner – ikke forhindre dem.
"Ville det ikke være fantastisk, hvis der var en sikker og effektiv behandling af fødevareallergi, der konsekvent gjorde det muligt at genindføre en fødevare i kosten, som du plejede strengt at undgå?"
Scott er Kay Davis-professor i biomedicinsk teknik ved Northwesterns McCormick School of Engineering og medlem af Simpson Querrey Institute for BioNanotechnology og af International Institute for Nanotechnology. Bochner er Samuel M. Feinberg emeritus professor i medicin (allergi og immunologi) ved Northwestern University Feinberg School of Medicine.
Avisens første forfatter er Fanfan Du, en postdoc-stipendiat i Scotts laboratorium, som arbejdede tæt sammen med co-first forfattere Clayton Rische, en Ph.D. kandidat medmentor af både Bochner og Scott, og Yang Li, en Ph.D. kandidat i Scott-laboratoriet.
Svært mål
Placeret i næsten alle væv i hele menneskekroppen, er mastceller bedst kendt for at være primært ansvarlige for allergiske reaktioner. Men de spiller også flere andre vigtige roller, herunder regulering af blodgennemstrømningen og bekæmpelse af parasitter. Derfor kan fuldstændig eliminering af mastceller for at forhindre allergiske reaktioner være skadeligt for andre nyttige, sunde reaktioner.
"Selvom nogle lægemidler er under udvikling, er der i øjeblikket ingen FDA-godkendte lægemidler, der hæmmer eller eliminerer mastceller," sagde Bochner. "Dette har hovedsageligt været vanskeligt, fordi lægemidler, der kan påvirke mastcelleaktivering eller overlevelse, også målretter mod andre celler end mastceller og dermed har en tendens til at have uønskede bivirkninger på grund af påvirkninger på andre celler."
I tidligere arbejde identificerede Bochner Siglec-6, en unik hæmmende receptor, der i høj grad og selektivt findes på mastceller. Hvis forskere kunne målrette mod den receptor med et antistof, så kunne de selektivt hæmme mastceller for at forhindre allergi. Men at introducere dette antistof i sig selv kom til kort.
"Det var svært at få en høj nok koncentration af antistoffet til at have en effekt," sagde Scott. "Vi spekulerede på, om vi kunne øge denne koncentration ved hjælp af en nanopartikel. Hvis vi kunne pakke en høj tæthed af antistoffer på en nanopartikel, så kunne vi gøre den praktisk at bruge."
Klæber antistoffer på en partikel
For at pakke antistofferne på en nanopartikel måtte Scott og hans team overvinde en anden udfordring. For at proteiner (som antistoffer) skal klæbe til en nanopartikel, skal de typisk danne en kemisk binding, der udfolder (eller denaturerer) proteinet, hvilket påvirker dets biologiske aktivitet. For at omgå denne udfordring henvendte Scott sig til en nanopartikel, der tidligere var udviklet i hans laboratorium.
I modsætning til mere standard nanopartikler, der har stabile overflader, omfatter Scotts nyudviklede nanopartikel dynamiske polymerkæder, som uafhængigt kan vende deres orientering ved eksponering for forskellige opløsningsmidler og proteiner. Når de sættes i flydende opløsninger, orienterer kæderne sig for at opnå gunstige elektrostatiske interaktioner med vandmolekyler.
Men når et protein rører nanopartikeloverfladen, vender de specifikke små polymerkæder ved grænsefladen deres orienteringer for stabilt at holde på proteinet uden at binde sig kovalent til det. Scotts team fandt også ud af, at vandafvisende lommer på proteinoverflader var nøglen til den stabile interaktion.
Når proteiner bindes til overflader, denaturerer de typisk og mister deres bioaktivitet. Et unikt aspekt ved Scotts nanopartikler er, at de stabilt kan binde enzymer og antistoffer og samtidig bevare deres 3D-struktur og biologiske funktioner. Dette betyder, at anti-Siglec-6-antistofferne bibeholdt deres stærke affinitet for mastcellereceptorerne – selv når de var knyttet til nanopartikeloverfladen.
"Dette er en unik dynamisk overflade," sagde Scott. "I stedet for en standard stabil overflade kan den skifte overfladekemi. Den er lavet af små polymerkæder af forbindelser, som kan vende deres orientering for at maksimere gunstige interaktioner med både vand og proteiner efter behov."
Da Scotts team blandede nanopartiklerne med antistoffer, var tæt på 100 % af antistofferne med succes knyttet til nanopartiklerne uden at miste deres evne til at binde sig til deres specifikke mål. Dette resulterede i en nanopartikelbaseret terapi, der anvender overflader med tætpakkede og meget kontrollerbare mængder af flere forskellige antistoffer mod målmastceller.
Selektiv nedlukning
For at nogen kan blive allergisk, fanger og viser deres mastceller antistoffer, specifikt immunglobulin E (IgE) antistoffer, for det specifikke allergen. Dette gør det muligt for mastcellerne at genkende - og reagere på - det samme allergen ved geneksponering.
"Hvis du har en jordnøddeallergi og tidligere har haft en reaktion på jordnødder, så lavede dine immunceller IgE-antistoffer mod jordnøddeproteiner, og mastcellerne samlede dem," sagde Scott. "Nu venter de på, at du spiser endnu en jordnød. Når du gør det, kan de reagere inden for få minutter, og hvis responsen er kraftig nok, kan det resultere i anafylaksi."
For selektivt at målrette mastceller til at reagere på et bestemt allergen, designede forskerne deres terapi til kun at engagere mastceller, der bærer IgE-antistoffer for det allergen. Nanopartiklerne bruger et proteinallergen til at engagere sig med IgE-antistoffer på mastcellerne og bruger derefter et antistof til at engagere Siglec-6-receptoren for at lukke mastcellens evne til at reagere. Og fordi kun mastceller viser Siglec-6-receptorer, kan nanopartikler ikke binde til andre celletyper - en strategi, der effektivt begrænser bivirkninger.
"Du kan bruge et hvilket som helst allergen, du ønsker, og du vil selektivt lukke ned for reaktionen på det allergen," sagde Scott. "Allergenet ville normalt aktivere mastcellen. Men samtidig binder allergenet, antistoffet på nanopartiklerne engagerer også den hæmmende Siglec-6-receptor. På baggrund af disse to modstridende signaler beslutter mastcellen sig for, at den ikke skal aktiveres og bør lade det allergen være i fred. Det stopper selektivt en reaktion på et bestemt allergen. Skønheden ved denne fremgangsmåde er, at den ikke kræver, at alle mastceller bliver slået ihjel celletype, vil den celle bare ikke reagere."
Forebyggelse af anafylaksi hos mus
Efter at have demonstreret succes i cellulære kulturer ved hjælp af humane vævs-afledte mastceller, flyttede forskerne deres terapi ind i en humaniseret musemodel. Fordi mastceller i mus ikke har Siglec-6-receptoren, udviklede Bochners team en musemodel med humane mastceller i deres væv. Forskerne udsatte musene for et allergen og afgav nanoterapien på samme tid.
Ingen mus oplevede anafylaktisk shock og alle overlevede.
"Den enkleste måde at overvåge en allergisk reaktion på er at spore ændringer i kropstemperaturen," sagde Scott. "Vi så ingen ændringer i temperaturen. Der var ingen reaktion. Musene forblev desuden sunde og viste ingen ydre tegn på en allergisk reaktion."
"Musemastceller har ikke Siglec-6 på deres overflade som hos mennesker, men vi kom så tæt på, som vi kunne for nu, på faktiske menneskelige undersøgelser ved at teste disse nanopartikler i specielle mus, der havde menneskelige mastceller i deres væv," sagde Bochner . "Vi var i stand til at vise, at disse humaniserede mus var beskyttet mod anafylaksi."
Dernæst planlægger forskerne at udforske deres nanoterapi til behandling af andre mastcelle-relaterede sygdomme, herunder mastocytose, en sjælden form for mastcellekræft. De undersøger også metoder til at indlæse lægemidler inde i nanopartiklerne for selektivt at dræbe mastceller i mastocytose uden at skade andre celletyper.
Flere oplysninger: Fanfan Du et al, Kontrolleret adsorption af flere bioaktive proteiner muliggør målrettet mastcelle nanoterapi, Nature Nanotechnology (2024). DOI:10.1038/s41565-023-01584-z
Journaloplysninger: Natur nanoteknologi
Leveret af Northwestern University
 Varme artikler
Varme artikler
-
 Spinat og nanodiamanter?Mikroskopbillede af små diamanter, 100 mikrometer i diameter. Specifikke gitterdefekter giver ikke kun farve til diamanterne, men danner også grundlaget for magnetfeltsensoren. I deres eksperimenter s
Spinat og nanodiamanter?Mikroskopbillede af små diamanter, 100 mikrometer i diameter. Specifikke gitterdefekter giver ikke kun farve til diamanterne, men danner også grundlaget for magnetfeltsensoren. I deres eksperimenter s -
 Udskrivbare bioniske øre blander elektronik og biologiForskere brugte 3-D-print til at fusionere væv og en antenne, der var i stand til at modtage radiosignaler. Kredit:Frank Wojciechowski Forskere ved Princeton University brugte off-the-shelf printv
Udskrivbare bioniske øre blander elektronik og biologiForskere brugte 3-D-print til at fusionere væv og en antenne, der var i stand til at modtage radiosignaler. Kredit:Frank Wojciechowski Forskere ved Princeton University brugte off-the-shelf printv -
 Single-atom nanozymerSyntetisk skema og morfologi karakterisering af FeN5SA/CNF. (A) Skematisk dannelsesproces af carbon nanoframe-begrænsede atomisk dispergerede Fe-steder med aksial fem-N-koordinering for at efterligne
Single-atom nanozymerSyntetisk skema og morfologi karakterisering af FeN5SA/CNF. (A) Skematisk dannelsesproces af carbon nanoframe-begrænsede atomisk dispergerede Fe-steder med aksial fem-N-koordinering for at efterligne -
 Elefant- og komødning til bæredygtig fremstilling af papirPapir (øverst) kan fremstilles af cellulose afledt af elefantgødning (nederst). Kredit:Kathrin Weiland Det er sandsynligvis ikke det første, du tænker på, når du ser elefantmødding, men dette mate
Elefant- og komødning til bæredygtig fremstilling af papirPapir (øverst) kan fremstilles af cellulose afledt af elefantgødning (nederst). Kredit:Kathrin Weiland Det er sandsynligvis ikke det første, du tænker på, når du ser elefantmødding, men dette mate
- Ny måling giver mindre protonradius
- Kunne WikiLeaks overleve uden Julian Assange?
- Der er fundet beviser for magnetisme ved kanterne af grafen
- Forskel mellem 6011 og 7018 svejsestænger
- Arbejdsløshed under den store recession fodrede venstrefløjspopulismen; uautoriserede immigrations…
- Nyt værktøj tillader hidtil uset modellering af magnetiske nanopartikler


