Oprettelse af nye aminosyrenanopartikler med forbedret anticanceraktivitet
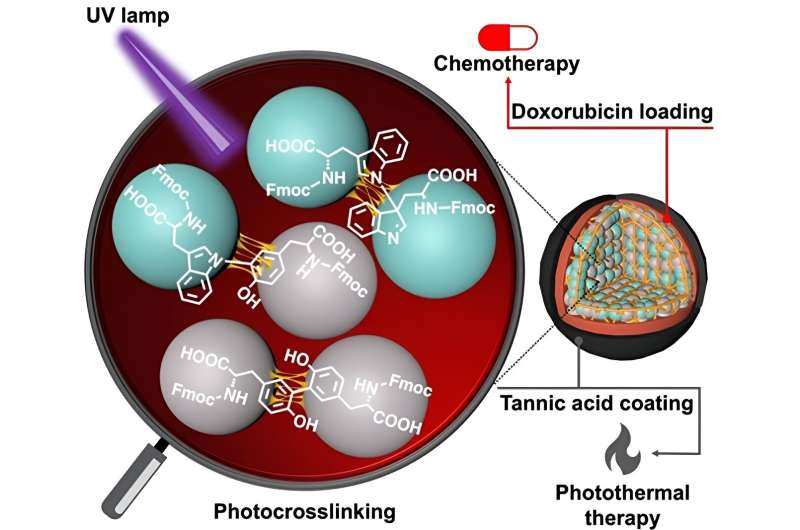
Aminosyrer, såsom tyrosin og tryptofan, er de grundlæggende byggesten, der udgør proteiner. Disse biomolekyler har forskellige kemiske grupper på hver ende og sidekæde, og har derfor den naturlige evne til at danne en kæde gennem dannelsen af en amid (peptid) binding. Sådanne bindinger er imidlertid svage og nedbrydes let under fysiologiske forhold. Det er her de Fmoc-beskyttede aminosyrer kommer ind i billedet.
I en ny undersøgelse nu viser et forskerhold ledet af Dr. Eijiro Miyako, lektor, Japan Advanced Institute of Science and Technology (JAIST) og Dr. Alberto Bianco og Dr. Cécilia Ménard-Moyon fra Centre National de la Recherche Scientifique ( CNRS), Frankrig, anvendte ultraviolet lys ved 254 nm (førende til CBPUV nanopartikler) og riboflavin-medieret tværbinding ved 365 nm (førende til CBPRibo nanopartikler) til at tværbinde de Fmoc-beskyttede aminosyrer.
"Aminosyrer, der er byggestenene i proteiner, har adskillige fordele, såsom bedre biokompatibilitet. Derfor ønskede vi at skabe nye selvsamlede aminosyrebaserede nanopartikler, som kan udløses gennem flere mekanismer," siger Dr. Eijiro Miyako. Resultaterne af denne undersøgelse er offentliggjort i Small .
De selvsamlede aminosyrer var stabilt tværbundne dimerer af Fmoc-Tyr-OH (Tyrosin) og Fmoc-Trp-OH (Tryptophan). Doxorubicin, et lægemiddel mod kræft, blev efterfølgende fyldt i de tværbundne aminosyrenanopartikler.
For at øge stabiliteten af nanopartiklerne brugte forskerne et garvesyre-jern (Fe 3+ ) kompleks (eller TAF) som det ydre lag af belægning. Denne belægning kan nedbrydes inde i cellerne gennem glutathionenzymatisk frigivelse eller ved pH-forskel i tumormikromiljøet. Garvesyrebelægningen kan også bruges i fototermisk anticancerterapi, hvor eksternt lys kan øge den lokale temperatur omkring kræftvævet og forårsage kræftcelledød.
De syntetiserede nanopartikler blev derefter grundigt undersøgt for deres strukturelle integritet, stabilitet og lægemiddelfrigivelse under forskellige pH-forhold. Den funktionelle profil, cellulær optagelse og biokompatibilitet af selvsamlede aminosyrenanopartikler blev derefter undersøgt ved hjælp af cellekulturteknikker.
Endelig blev anticancer-effektiviteten af syntetiserede nanopartikler analyseret i tumorbærende mus. Den kombinerede tilgang med kemoterapi på grund af doxorubicin-virkning og fototermisk terapi takket være garvesyrebelægningen viste fremragende anticanceraktivitet.
Efter tværbinding viste de aminosyrebaserede nanopartikler bemærkelsesværdige ændringer i farve, størrelse, absorbans, fluorescens og termisk stabilitet. Endvidere udviste CBPUV overlegen stabilitet efter tværbinding sammenlignet med CBPRibo. CBPUV bibeholdt også konsekvent sin struktur, mens CBPRibo viste delvis adskillelse og dannede hule kugler.
Lægemiddelfrigivelsesundersøgelse afslørede minimal lægemiddelfrigivelse under fysiologisk pH (7,4), hvilket indikerer, at stabil belægning er afgørende for in vivo-levering. Ved pH 5,5 resulterede ufuldstændig belægningsnedbrydning i ubetydelig lægemiddelfrigivelse. Tilsætningen af glutathion (GSH) ved pH 5,5 øgede imidlertid lægemiddelfrigivelsen betydeligt ved at udløse nedbrydning af TAF-coating, hvilket indikerer GSH/pH-responsivitet.
Den kombinerede syre- og GSH-behandling intensiverede belægningsnedbrydningen. Denne responsive adfærd muliggør kontrolleret lægemiddelfrigivelse under specifikke fysiologiske forhold. Endvidere afslørede in vitro-vurderinger koncentrationsafhængig cytotoksicitet og forbedret effektivitet i kombineret kemo-/fototermisk behandling. In vivo-undersøgelser på tumorbærende mus viste betydelig hæmning af tumorvækst, hvilket indikerer lovende anticancer-effekter uden observerede bivirkninger.
Dr. Miyako sagde:"Nanoteknologi lover at omdanne grundlæggende laboratorievidenskab til et kraftfuldt værktøj til bekæmpelse af komplekse sygdomme som kræft. Vi er optimistiske om, at denne banebrydende forskning vil udvikle sig og potentielt udvikle sig til banebrydende kræftbehandlingsteknologi, klar til kliniske forsøg inden for ti år."
Fremover kan udviklingen af disse selvsamlede aminosyrenanopartikler hjælpe med at bekæmpe kritiske problemer såsom multi-lægemiddelresistens i kræft og forbedre den overordnede effektivitet af behandlingsresultater.
Flere oplysninger: Tengfei Wang et al., Photocrosslinked Co-Assembled Amino Acid Nanopartikler til kontrolleret kemo/fototermisk kombineret anticancerterapi, Small (2023). DOI:10.1002/sml.202307337
Journaloplysninger: Lille
Leveret af Japan Advanced Institute of Science and Technology
 Varme artikler
Varme artikler
-
 Delikat åbning af et båndgab i grafen muliggør højtydende transistorer(a) der blev åbnet et båndgab i to-lags grafen ved kemisk doping med et elektron-donerende dopemiddel (BV) på bunden og et elektron-acceptabelt dopemiddel (atmosfæriske molekyler) på toppen, som skabe
Delikat åbning af et båndgab i grafen muliggør højtydende transistorer(a) der blev åbnet et båndgab i to-lags grafen ved kemisk doping med et elektron-donerende dopemiddel (BV) på bunden og et elektron-acceptabelt dopemiddel (atmosfæriske molekyler) på toppen, som skabe -
 Forskere laver ultrafølsom kræftdetektor af 2D-materialerTodimensionel materialebaseret elektrisk strømsensor til påvisning af kræftceller. Kredit:SUTD Celler kan producere unikke elektriske signaler. Disse signaler kan kædes sammen med forskellige kræft
Forskere laver ultrafølsom kræftdetektor af 2D-materialerTodimensionel materialebaseret elektrisk strømsensor til påvisning af kræftceller. Kredit:SUTD Celler kan producere unikke elektriske signaler. Disse signaler kan kædes sammen med forskellige kræft -
 Glas nanopore trækker DNA som spaghetti gennem en nålEn illustration, der viser (a) hvordan et glasrør med en lille åbning og en positiv elektrode, når det indsættes i en væskeprøve og stimuleres med elektricitet, opsamler cellefrit DNA, der flyder i pr
Glas nanopore trækker DNA som spaghetti gennem en nålEn illustration, der viser (a) hvordan et glasrør med en lille åbning og en positiv elektrode, når det indsættes i en væskeprøve og stimuleres med elektricitet, opsamler cellefrit DNA, der flyder i pr -
 Quantum dots-teknologi til at revolutionere sundhedspleje og sensorteknologiKredit:Oulu Universitet Forskere fra Optoelectronics and Measurement Techniques Unit (OPEM) ved University of Oulu har opfundet en ny metode til fremstilling af ultrafølsomme hyper-spektrale fotod
Quantum dots-teknologi til at revolutionere sundhedspleje og sensorteknologiKredit:Oulu Universitet Forskere fra Optoelectronics and Measurement Techniques Unit (OPEM) ved University of Oulu har opfundet en ny metode til fremstilling af ultrafølsomme hyper-spektrale fotod


