Molecular jackhammers kan sprænge melanomcellernes membran, viser undersøgelse
The Beach Boys' ikoniske hitsingle "Good Vibrations" får et helt nyt lag af betydning takket være en nylig opdagelse af Rice University-forskere og samarbejdspartnere, som har afsløret en måde at ødelægge kræftceller ved at bruge nogle molekylers evne til at vibrere kraftigt når det stimuleres af lys.
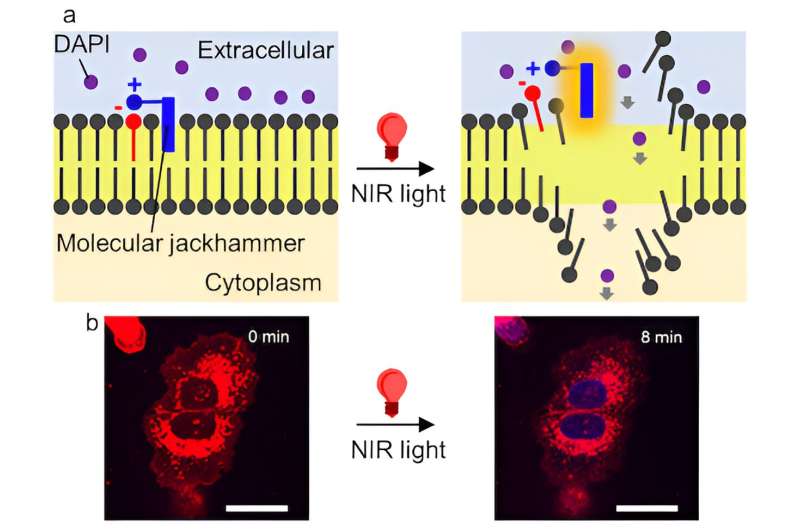
Forskerne fandt ud af, at atomerne i et lille farvestofmolekyle, der bruges til medicinsk billeddannelse, kan vibrere i forening - og danne det, der er kendt som en plasmon - når de stimuleres af nær-infrarødt lys, hvilket får kræftcellernes cellemembran til at briste. Ifølge undersøgelsen offentliggjort i Nature Chemistry , metoden havde en effektivitet på 99 % mod laboratoriekulturer af humane melanomceller, og halvdelen af musene med melanomtumorer blev kræftfrie efter behandling.
"Det er en helt ny generation af molekylære maskiner, som vi kalder molekylære hammerhammere," sagde Rice kemiker James Tour, hvis laboratorium tidligere har brugt forbindelser i nanoskala udstyret med en lysaktiveret paddle-lignende kæde af atomer, der spinder konstant i samme retning for at bore igennem. den ydre membran af infektiøse bakterier, kræftceller og behandlingsresistente svampe.
I modsætning til øvelserne i nanoskala baseret på nobelpristageren Bernard Feringas molekylære motorer, anvender molekylære hammere en helt anden – og hidtil uset – virkningsmekanisme.
"De er mere end en million gange hurtigere i deres mekaniske bevægelse end de tidligere motorer af Feringa-typen, og de kan aktiveres med nær-infrarødt lys i stedet for synligt lys," sagde Tour.
Nær-infrarødt lys kan trænge langt dybere ind i kroppen end synligt lys og få adgang til organer eller knogler uden at beskadige væv.
"Nær-infrarødt lys kan gå så dybt som 10 centimeter (~ 4 tommer) ind i den menneskelige krop i modsætning til kun en halv centimeter (~ 0,2 tommer), dybden af gennemtrængning for synligt lys, som vi brugte til at aktivere nanoborerne, " sagde Tour, Rice's T. T. og W. F. Chao professor i kemi og en professor i materialevidenskab og nanoteknik. "Det er et kæmpe fremskridt."
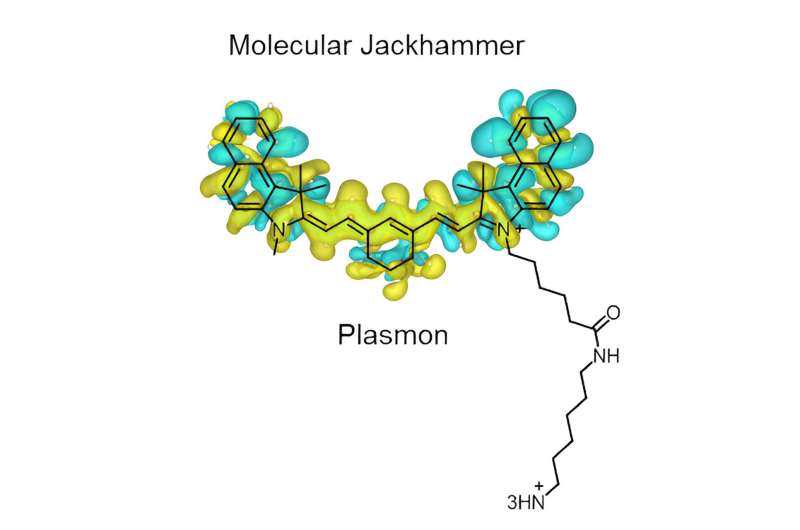
Hammerne er aminocyaninmolekyler, en klasse af fluorescerende syntetiske farvestoffer, der bruges til medicinsk billeddannelse.
"Disse molekyler er simple farvestoffer, som folk har brugt i lang tid," sagde Ciceron Ayala-Orozco, en risforsker, som er hovedforfatter på undersøgelsen. "De er biokompatible, stabile i vand og meget gode til at binde sig til den fede ydre beklædning af celler. Men selvom de blev brugt til billeddannelse, vidste folk ikke, hvordan de skulle aktivere disse som plasmoner."
Ayala-Orozco studerede oprindeligt plasmons som doktorand i forskningsgruppen ledet af Rices Naomi Halas.

"På grund af deres struktur og kemiske egenskaber kan kernerne i disse molekyler oscillere synkront, når de udsættes for den rigtige stimulus," sagde Ayala-Orozco. "Jeg så et behov for at bruge egenskaberne ved plasmoner som en form for behandling og var interesseret i Dr. Tours mekaniske tilgang til håndtering af kræftceller. Jeg forbandt dybest set prikkerne.
"De molekylære plasmoner, vi identificerede, har en næsten symmetrisk struktur med en arm på den ene side. Armen bidrager ikke til den plasmoniske bevægelse, men den hjælper med at forankre molekylet til lipid-dobbeltlaget i cellemembranen."
Forskerne skulle bevise, at molekylernes virkemåde hverken kunne kategoriseres som en form for fotodynamisk eller fototermisk terapi.
"Det, der skal fremhæves, er, at vi har opdaget en anden forklaring på, hvordan disse molekyler kan fungere," sagde Ayala-Orozco. "Dette er første gang en molekylær plasmon bruges på denne måde til at excitere hele molekylet og faktisk producere mekanisk handling, der bruges til at opnå et bestemt mål - i dette tilfælde at rive kræftcellers membran fra hinanden. Denne undersøgelse handler om en anden måde at behandle kræft ved hjælp af mekaniske kræfter på molekylær skala."
Forskere ved Texas A&M University ledet af Jorge Seminario, en kvantekemiker og professor i kemiteknik, udførte tidsafhængige tæthedsfunktionsteoretiske analyser af de molekylære træk involveret i jackhammering-effekten. Kræftundersøgelserne blev udført i mus ved University of Texas MD Anderson Cancer Center i samarbejde med Dr. Jeffrey Myers, professor og formand for afdelingen for hoved- og halskirurgi og direktør for translationel forskning for afdelingen for kirurgi.
Flere oplysninger: Ciceron Ayala-Orozco et al., Molecular jackhammers udrydder kræftceller ved vibronic-drevet handling, Nature Chemistry (2023). DOI:10.1038/s41557-023-01383-y
Journaloplysninger: Naturkemi
Leveret af Rice University
 Varme artikler
Varme artikler
-
 Forskere udvikler platform til at undersøge terapeutiske nanomaterialerDen øverste række angiver mus med glioblastom kontrolleret for tumorstørrelse. Den nederste række viser deres udtryk for MGMT, et protein, der gør tumorceller mere resistente over for kemoterapi. Vens
Forskere udvikler platform til at undersøge terapeutiske nanomaterialerDen øverste række angiver mus med glioblastom kontrolleret for tumorstørrelse. Den nederste række viser deres udtryk for MGMT, et protein, der gør tumorceller mere resistente over for kemoterapi. Vens -
 Russiske dukkepolymer-vesikler efterligner cellestrukturDiagram, der viser de eksterne polymersomer mærket med en grøn fluorofor, der indkapsler de indre polymersomer mærket med en rød fluorofor, sammen med et roterende disk konfokalt mikroskopibillede. Kr
Russiske dukkepolymer-vesikler efterligner cellestrukturDiagram, der viser de eksterne polymersomer mærket med en grøn fluorofor, der indkapsler de indre polymersomer mærket med en rød fluorofor, sammen med et roterende disk konfokalt mikroskopibillede. Kr -
 Ny teknik kan betyde super tynd, stærke grafen-baserede kredsløbSkematisk illustration af enkeltatom-tykke film med mønstrede områder af ledende grafen (grå) og isolerende bornitrid (lilla-blå). (Phys.org)—Integrerede kredsløb, som er i alt fra kaffemaskiner t
Ny teknik kan betyde super tynd, stærke grafen-baserede kredsløbSkematisk illustration af enkeltatom-tykke film med mønstrede områder af ledende grafen (grå) og isolerende bornitrid (lilla-blå). (Phys.org)—Integrerede kredsløb, som er i alt fra kaffemaskiner t -
 Ingeniører udvikler ultratynde, ultralet nanokortNanokarton er lavet af en aluminiumoxidfilm med en tykkelse på titusvis af nanometer, danner en hul plade med en højde på titalls mikron. Dens sandwichstruktur, svarende til bølgepap, gør den mere end
Ingeniører udvikler ultratynde, ultralet nanokortNanokarton er lavet af en aluminiumoxidfilm med en tykkelse på titusvis af nanometer, danner en hul plade med en højde på titalls mikron. Dens sandwichstruktur, svarende til bølgepap, gør den mere end
- Mønstre af befolkningsvæksten i et økosystem
- Hvordan en simpel psykologisk intervention kunne hjælpe med at øge skolekaraktererne for elever me…
- Japansk tycoon planlægger rumstation besøg, derefter månerejse
- Forskere går ind for at bryde lovene - om geografi og økologi
- Forskning viser, at fortjeneste er yderst subjektiv og ændrer sig med vores værdier
- E-learning og Nintendo:håndtering af virusskolelukninger


