Viral forbedring af nanomateriale kræftsensor forbedrer tidlig påvisning
Forskere fra SUTD har udviklet et avanceret system til påvisning af brystkræftceller med forbedret hastighed og følsomhed, ved at bruge en viral mekanisme til at forbedre værktøjets sansningsnøjagtighed.
I den globale kamp mod brystkræft kan styrken af diagnostiske værktøjer betyde forskellen mellem liv og død. Overlevelsesrater for sygdommen er væsentligt forbedret, når kræften opdages tidligt, mens påvisning efter behandling er altafgørende for at verificere effektiviteten af behandlingen.
Biomarkører er vigtige i kræftforskningens arsenal, da de letter tidlig påvisning og kan hjælpe med at indikere maligne celler efter behandling for at afgøre, om der er spor af kræft tilbage. At opnå akut følsomhed er derfor afgørende. Imidlertid er den relative mængde af kræftceller i tilfælde i de tidlige stadier eller efterbehandling ofte minimal, hvilket gør deres påvisning udfordrende.
Lektor Desmond Loke fra Singapore University of Technology and Design (SUTD) foreslog en ny løsning på dette problem i et nyligt papir, "Shape complementarity processes for ultrashort-burst sensitive M13–PEG–WS2-powered MCF-7 cancer cell sensors, " udgivet i Nanoscale .
"Størstedelen af patienterne udviser ikke symptomer i de tidlige stadier, og de eksisterende diagnostiske teknikker, som kan være unøjagtige, dyre og tidskrævende, involverer billeddiagnostiske tests," forklarede Loke, projektets hovedefterforsker. "Målet med forskningen var at skabe en platform, der kan identificere og behandle brystkræft hos patienter, før de viser alvorlige symptomer."
For at udvikle et celledetekteringssystem med den højest mulige følsomhed ledede Loke et forskerhold – bestående af kolleger fra SUTD og samarbejdspartnere fra University College London og A*STAR – der brugte værktøjer i den mindste tænkelige skala og arbejdede med nanomaterialer. Den nuværende teknologi til påvisning af kræftceller er en digital biomolekylær sensor (DBS).
Mekanismen fungerer som følger:et kemisk genkendelseselement identificerer disse molekyler og konverterer deres interaktion til et digitalt signal, der let kan måles og analyseres. Denne teknologi er beslægtet med et højt specialiseret detektivværktøj på molekylært niveau, med evnen til at identificere specifikke biologiske mål, såsom kræftcelleproteiner, og oversætte denne information til elektriske signaler, som forskere kan bruge til diagnostisk forskning eller overvågning.
Dette system er imidlertid ikke særlig nyttigt til populationer med lavt celletal. Forskerholdet antog en hypotese om et nydesignet system, der ville give højere følsomhed med forbedring fra et stærkt ledende nanomateriale med en streng af viral fag, der interagerer med specifikke cancerceller.
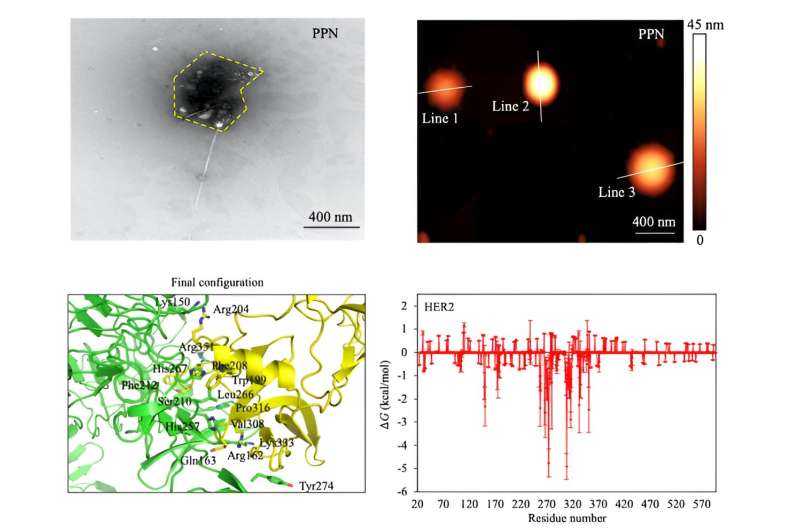
Forbedring af systemet krævede et nyt 2D nanomateriale med tilstrækkelig elektrisk ledningsevne til kraftigt at interagere med cancercelletyper. Forskerne besluttede sig for wolframdisulfid for dets høje ledningsevne og brug i fototransistorer og fototermisk terapi. De udstyrede plader af wolframdisulfid med en fag-kombineret polymer, der fungerede som et genkendelseselement for de brystkræftcelletyper, der blev testet. Integrering af det virale middel, eller den fag-kombinerede polymer, i nanomaterialet skabte et nyt system kaldet fag-baseret DBS (P-DBS).
"For P-DBS-teknologien, når en virus føjes til brystkræftcelleprøven, kan virusets proteiner udvise en høj specificitet for samling på brystkræftceller. Det er dog muligt, at virusproteinet udviser en specificitet, der er høj nok til at samles på brystkræftceller til et meget lille antal celler, hvilket resulterer i ultrahøj sansenøjagtighed," sagde Loke.
Brystcancerceller blev undersøgt til dette projekt, fordi virale proteiner let samles på deres overflade, hvilket muliggør en jævnere forbindelse mellem P-DBS-biosensorplatformen og prøvecellerne. Ifølge Loke giver denne formkomplementaritetseffekt mulighed for "ultra-præcis prøveudtagning, hvilket er afgørende for tidlig kræftpåvisning og overvågning af sygdomsprogression."
Fire kriterier skal være opfyldt for at betragte en biosensor som yderst effektiv i en klinisk kontekst. Biosensoren skal (1) være meget følsom over for tilstedeværelsen af cancercelleproteiner, (2) producere markant kontrast i outputsignaler, (3) sikre høj cellelevedygtighed og (4) producere resultater inden for den korte aflæsningstid, der er almindelig i kliniske applikationer .
P-DBS kontrollerede alle boksene med rimelig følsomhed. Den nye teknik var i stand til at identificere tilstedeværelsen af kræftceller i prøver, der var omkring 74 % mindre end de typiske cellegruppestørrelser for andre elektrisk-baserede kræftcellesensorer. P-DBS overgik også andre elektrisk-baserede cancersensorer med hensyn til signalkontrast med 58 %.
Disse imponerende resultater kan tilskrives specificiteten af det virale protein, som forskerne påviste ville samle sig på selv det mindste antal brystkræftceller og derfor indikerer tilstedeværelsen af kræft selv i de tidlige stadier.
"Skabelsen af den virusdrevne 2D-materialesensorplatform kan repræsentere et betydeligt fremskridt i kampen mod brystkræft. Hvis resultaterne bekræftes i fremtidige kliniske undersøgelser, kan denne sensor blive et værdifuldt nøjagtigt værktøj til at identificere brystkræft i dens tidlige stadier ," tilføjede Loke.
Gennem yderligere forskning håber han at bekræfte, at P-DBS-systemet er bredt anvendeligt på tværs af forskellige brystkræftcelletyper. Den innovative biosensorplatform kan være vigtig for tidlig kræftdiagnose og overvågning og demonstrerer en lovende vej inden for biomolekylære sensorer i nanoskala.
Flere oplysninger: Maria P. Meivita et al., Formkomplementaritetsprocesser for ultrashort burst-følsomme M13–PEG–WS2-drevne MCF-7 cancercellesensorer, Nanoskala (2023). DOI:10.1039/D3NR03573E
Journaloplysninger: Nanoskala
Leveret af Singapore University of Technology and Design
 Varme artikler
Varme artikler
-
 Foreslået grafenpap har meget justerbare egenskaberModel af en grafenkarton. Kredit:Pekka Koskinen (Phys.org) - Kulstofnanomaterialer findes i mange forskellige former, såsom diamant, aerogeler, grafen, og sod. Nogle gange bruges kulstof nanomater
Foreslået grafenpap har meget justerbare egenskaberModel af en grafenkarton. Kredit:Pekka Koskinen (Phys.org) - Kulstofnanomaterialer findes i mange forskellige former, såsom diamant, aerogeler, grafen, og sod. Nogle gange bruges kulstof nanomater -
 Ingeniører udvikler grafenbaseret biosensor, der fungerer på tre måder på én gangForskernes biosensor har mekanisk, elektriske og optiske tilstande. (Phys.org) – Et af nanoteknologiens største løfter er at interagere med den biologiske verden, som vores egne celler gør, men nu
Ingeniører udvikler grafenbaseret biosensor, der fungerer på tre måder på én gangForskernes biosensor har mekanisk, elektriske og optiske tilstande. (Phys.org) – Et af nanoteknologiens største løfter er at interagere med den biologiske verden, som vores egne celler gør, men nu -
 Stryger oprindelsen af rynker, folder og folderEt fasediagram viser mængden af trykbelastning, der er nødvendig for at skabe rynker, folder og folder i gummiagtige materialer. Det lilla område angiver rynketilstanden, og vandområderne er to fold
Stryger oprindelsen af rynker, folder og folderEt fasediagram viser mængden af trykbelastning, der er nødvendig for at skabe rynker, folder og folder i gummiagtige materialer. Det lilla område angiver rynketilstanden, og vandområderne er to fold -
 Ny billig måde at dyrke siliciummikrotråde til sensorer, batterier og solcellerSmeltede dråber af kobber, øverst, opløse silicium ud af en omgivende siliciumholdig gas, og så udfælder siliciumet i bunden af dråben for gradvist at opbygge en siliciummikrotråd. Dette mikroskopbi
Ny billig måde at dyrke siliciummikrotråde til sensorer, batterier og solcellerSmeltede dråber af kobber, øverst, opløse silicium ud af en omgivende siliciumholdig gas, og så udfælder siliciumet i bunden af dråben for gradvist at opbygge en siliciummikrotråd. Dette mikroskopbi
- Undersøgelse viser, hvordan bioaktivt stof hæmmer vigtig receptor
- Undersøgelse:At fastholde talent er altafgørende for succesrige virksomhedsopkøb
- Sådan testes olieviskositet
- Atomisk opløsning af billeder af strålefølsomme materialer ved hjælp af transmissionselektronmik…
- Astronomer bekræfter kredsløb om det fjerneste objekt, der nogensinde er observeret i vores solsys…
- Hvordan forstærker vandet ting?


