En nanoprobe med en stregkode:Sensorer registrerer aktive proteaser
Proteinspaltende enzymer spiller en vigtig rolle i mange fysiologiske processer. Sådanne proteaser er generelt til stede i en inaktiv tilstand, idet de kun bliver aktiveret under visse betingelser. Nogle er forbundet med sygdomme som infektioner eller kræft, hvilket gør det vigtigt at have metoder, der selektivt kan påvise aktive proteaser.
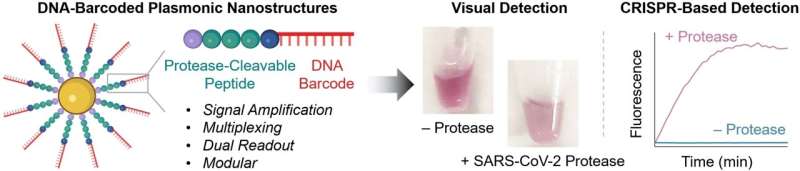
I en artikel offentliggjort i tidsskriftet Angewandte Chemie International Edition , har forskere introduceret en ny klasse af protease-aktivitetssensorer:guld nanopartikler udstyret med peptid-DNA.
Ledet af Devleena Samanta og Anna Capasso (The University of Texas i Austin, USA) har holdet vist, at disse nanoprober kan registrere flere aktive proteaser parallelt (multiplekset måling). Metoden fungerer ved stuetemperatur og kræver ikke kompliceret prøveforberedelse eller komplicerede instrumenter.
Kernen i de nye prober er guldnanopartikler udstyret med kæder lavet af et peptid og et DNA-fragment. Peptidstrukturen er designet til at være en, der spaltes af proteasen, der detekteres. DNA'et fungerer som en unik stregkode til at identificere peptidet og forstærker også signalet. Hvis den ønskede protease er til stede i sin aktive form i prøven, spalter peptidet den. Dette frigiver DNA-stregkoden i opløsningen, hvor den kan detekteres baseret på dens sekvens.
For at udføre denne påvisning bruger holdet en CRISPR/Cas12a-test:enzymet Cas12a er bundet til et guide-RNA (gRNA) for at danne et inaktivt kompleks. gRNA'et indeholder et segment, der specifikt binder til stregkode-DNA'et. Dette aktiverer Cas12a, så det nu kan "skære" enkeltstrenget DNA (ssDNA).
Til testen tilføjer forskerne ssDNA-molekyler med en fluorescerende gruppe (fluorofor) i den ene ende og en quencher, som "slukker" fluorescensen af fluoroforen (så længe de er tæt nok på) i den anden. Hvis ssDNA'et skæres op, bevæger fluoroforen og quencheren sig længere fra hinanden. Dette resulterer i stærk fluorescens, der indikerer, at proteasen, der testes for, er til stede (detektionsgrænse på ca. 58 pM).
Hvis ingen instrumenter er tilgængelige på stedet, og testen skal gå hurtigt, er påvisning mulig med det blotte øje:Hvis proteasen spalter peptidet på sonden, ændres overfladeladningen af guldnanopartiklerne, og de aggregeres. Farven på disse såkaldte "plasmoniske nanostrukturer" afhænger væsentligt af deres aggregeringsgrad. Det er muligt at påvise nanomolære proteasekoncentrationer baseret på farveændringen i testopløsningen.
Multiplekset påvisning af proteaserne 3CL og caspase3 gjorde det muligt for holdet at demonstrere den høje følsomhed og selektivitet af deres nye metode. 3CL er en markør for aktiv coronavirusinfektion, og COVID-patienter har ofte også forhøjet aktivitet af apoptosemarkøren caspase3. Det kliniske potentiale af denne test blev også demonstreret ved påvisning af cathepsin B, en protease relateret til kolorektal cancer, i tre forskellige tumorcellelinjer opnået fra patienter.
Disse nanoprober giver 100 gange højere fluorescenssignaler sammenlignet med kommercielle fluorescensbaserede proteasesensorer. Desuden kan praktisk talt enhver protease påvises, hvis det peptid, den spalter, er kendt. Tilsammen kan disse nanoprober potentielt muliggøre tidlig sygdomsdetektion og forbedre præcisionen og pålideligheden af diagnostiske tests gennem multipleksing.
Flere oplysninger: Subrata Pandit et al., DNA-stregkodede plasmoniske nanostrukturer til aktivitetsbaseret proteasesensing, Angewandte Chemie International Edition (2023). DOI:10.1002/anie.202310964
Journaloplysninger: Angewandte Chemie International Edition
Leveret af Wiley
 Varme artikler
Varme artikler
-
 Forskere skaber guld nanopartikler i vandGuld nanopartikler er knyttet til tråde af guld nanotråde. Begge strukturer blev dannet under anvendelse af en ny redoxreaktion, der involverede vanddråber. (Billedkredit:. Kredit:Jae Kyoo Lee Et
Forskere skaber guld nanopartikler i vandGuld nanopartikler er knyttet til tråde af guld nanotråde. Begge strukturer blev dannet under anvendelse af en ny redoxreaktion, der involverede vanddråber. (Billedkredit:. Kredit:Jae Kyoo Lee Et -
 Nanomagneter renser blodIllustrationen viser, hvordan nanomagnetrenseren fungerer. (Billede:ETH Zürich) Det er lykkedes schweiziske videnskabsmænd at fjerne et toksin fra blod på få minutter, ved hjælp af specialfremstil
Nanomagneter renser blodIllustrationen viser, hvordan nanomagnetrenseren fungerer. (Billede:ETH Zürich) Det er lykkedes schweiziske videnskabsmænd at fjerne et toksin fra blod på få minutter, ved hjælp af specialfremstil -
 Slowmotion elektroner:Ionfysik på femtosekundsskalaenMens de trænger gennem et tyndt materialelag, udsender højt ladede ioner mange elektroner, som er påvirket af fordelingen af de resterende elektroner i materialet. Kredit:Vienna University of Techno
Slowmotion elektroner:Ionfysik på femtosekundsskalaenMens de trænger gennem et tyndt materialelag, udsender højt ladede ioner mange elektroner, som er påvirket af fordelingen af de resterende elektroner i materialet. Kredit:Vienna University of Techno -
 Nanostoffer fra lamaer kunne give cellespecifik medicin til menneskerGrafisk abstrakt. Kredit:Sora Ji I proof of concept-eksperimenter med mus og humane celler og væv siger Johns Hopkins Medicine-forskere, at de har designet bittesmå proteiner, kaldet nanobodies, af
Nanostoffer fra lamaer kunne give cellespecifik medicin til menneskerGrafisk abstrakt. Kredit:Sora Ji I proof of concept-eksperimenter med mus og humane celler og væv siger Johns Hopkins Medicine-forskere, at de har designet bittesmå proteiner, kaldet nanobodies, af
- Glas og energireformen:Bæredygtig produktion takket være elektricitet?
- Polyimidmembraner til rensning af naturgas
- Inkjet print viser løfte som ny strategi for fremstilling af e-tekstiler, undersøgelse finder
- NASA fanger dannelsen af Atlantics rekordstore 15. tropiske storm
- Tusindvis af tons havforurening kan reddes ved at ændre vaskevaner
- Noget gav en overraskende stigning i metan på Mars


