CRISPR-drevne optotermiske nanotweezere
Optotermiske nanoweezer er en innovativ optisk designmetode, der har revolutioneret klassiske optiske teknikker til at fange en bred vifte af nanopartikler. Mens det optotermiske temperaturfelt kan bruges til in situ regulering af nanopartikler, er der stadig udfordringer med at identificere deres potentiale til at regulere bionanopartikler.
For at observere de synergistiske virkninger af optotermisk manipulation og CRISPR-baseret biodetektion (Clustered Regularly Interspaced Short Palindromic Repeats), udviklede forskerne en kombination af CRISPR-drevne optotermiske nanoweezere forkortet CRONT.
I en ny rapport i Light:Science &Applications , Jiajie Chen og et forskerhold inden for optoelektronikteknik, biomedicinsk teknik og fysik, opnåede dette ved at udnytte diffusioforese og termo-osmotiske strømme til optotermisk excitation ved succesfuldt at berige DNA-funktionaliserede guldnanopartikler, CRISPR-associerede proteiner og DNA-strenge.
Forskerne byggede på et optotermisk skema for at forbedre CRISPR-associeret enkelt-nukleotid polymorfi detektion på enkelt molekyle niveau, for at introducere en ny CRISPR-baseret metode til at observere nukleotid spaltning. Forskerne studerede denne innovative tilgang som et universelt område for diagnostik, biofotonik og bionanoteknologi.
Optisk pincet
I 1986 opfandt Arthur Ashkin en optisk pincet til at fjernregulere nanoobjekter og modtog en Nobelpris i fysik i 2018 for denne banebrydende opdagelse og bidrag til biologiske systemer. Mens en klassisk optisk pincet er afhængig af lysets momentumtransformation, har tværfaglige kombinationer på tværs af plasmonisk optik, elektrisk felt og temperatur effektivt adresseret grænserne.
En række innovative tilgange er dukket op for at tilbyde nye muligheder inden for partikelanalyse og regulering. Optotermiske nanotweezere bruger optisk-inducerede termodynamiske kræfter til at regulere nanopartikler i mikron-skalaen med sub-mikron præcision.
Sammenlignet med traditionelle optiske pincetter kræver optotermiske pincet en lavere effekttæthed, hvilket gør dem til et attraktivt alternativ til biologisk detektion, samtidig med at de reducerer de negative optiske virkninger på biologiske prøver. Da termiske effekter spiller en nøglerolle under en række biologiske processer, er det muligt at udnytte temperaturfeltets muligheder til praktiske anvendelser.
Metoden kan bruges til at regulere bionanopartikler lige fra mikro- til nanoskala til at omfatte bakterier og levende celler samt enkelt- og dobbeltstrengede DNA-molekyler og proteiner.
Kombinering af CRISPR med nanotweezer – CRONT
Det clustered regular interspaced short palindrome repeat (CRISPR) system tilbyder i sig selv et bemærkelsesværdigt genredigeringsværktøj, som også modtog en Nobelpris i 2020. Metoden omfattede et CRISPR-associeret nukleaseprotein og et mål-DNA-specifikt guide-RNA.
Biofysikere og bioingeniører er i stigende grad ivrige efter at forbedre følsomheden og alsidigheden af DNA-detektion ved at kombinere CRISPR-Cas-systemet med nye sensing-tilstande.
For at overvinde de eksisterende grænser for metoden designede Chen og kolleger en universelt anvendelig optotermisk tweezing-platform kendt som CRISPR-drevne optotermiske nanoweezere til at identificere bionanopartikler og brugte opsætningen til at identificere in situ DNA-molekyler uden nukleinsyreamplifikation. Eksperimenterne gav ultralave detektionsvolumener ved 10 μL for at identificere enkeltnukleotidpolymorfier for at studere genetisk diversitet, sygdomsmodtagelighed og lægemiddelrespons for at imødekomme de fremtidige krav fra genomisk forskning og medicin.
Arbejdsprincippet
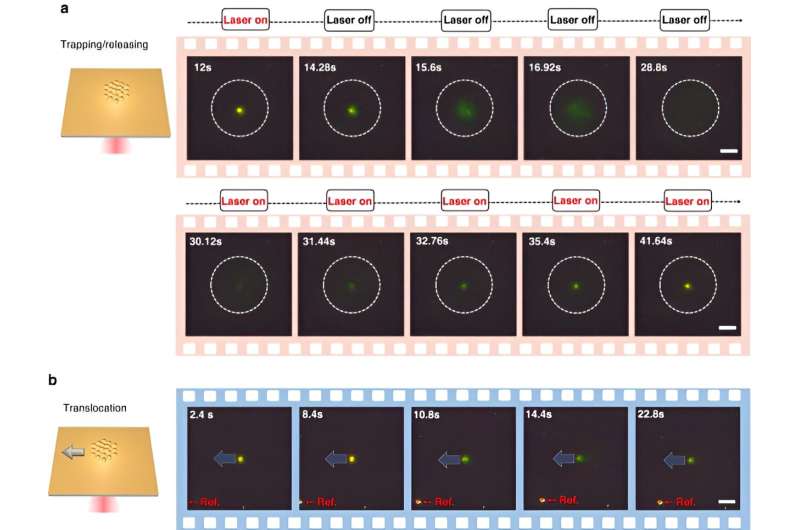
For at aktivere CRONT (CRISPR-drevne optotermiske nanotweezer) designede forskerne et mikrofluidkammer med et tyndt lag guldfilm aflejret på dækglasset. Da holdet bestrålede guldfilmen med laserbelysning, genererede de et temperaturfelt omkring laserpletten. Forskerne detaljerede de optimale betingelser for CRISPR-reaktioner og påbegyndte spaltningen af DNA-guld nanofilm-konjugatet ved hjælp af mørkfeltsmikroskopi.
De tilføjede en ikke-ionisk polymer af polyethylenglycol (PEG) i vandopløsningen som et biologisk overfladeaktivt middel for fremragende biokompatibilitet.
Tilstedeværelsen af flere nanopartikler og deres varierende termoforetiske mobilitet genererede en tydelig koncentration af opløst stof. Når opløste stoffer med øgede koncentrationer påvirkede dem med lavere koncentrationer gennem osmotisk tryk, resulterede resultaterne i en interaktion kendt som den diffusioforetiske kraft. Denne systematiske undersøgelse fremhævede potentialet for, at CRONT kan inkluderes til at udføre biomolekylær identifikation.
Optotermisk kombination af proteiner og DNA'er
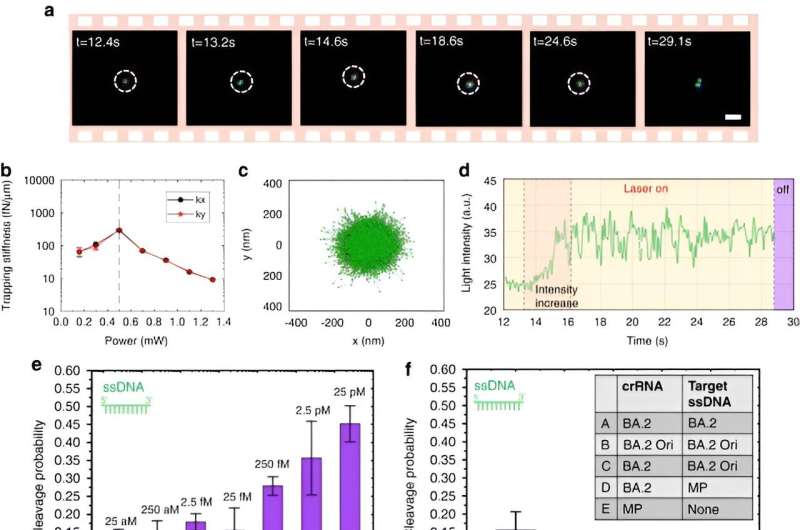
For at muliggøre CRISPR-drevne optotermiske nanotweezere studerede Chen og kolleger aggregeringsadfærden af proteiner og DNA'er ved at bruge fluorescensmærkning, hvor længden af den stive stilk genererede en polyethylenglycolkoncentrationsgradient. Mens en højere lasereffekt ikke kontinuerligt øgede akkumuleringshastigheden på grund af et forstørret termo-osmotisk flow, var akkumuleringen af enkeltstrenget DNA højere end dobbeltstrenget DNA. Mens proteinakkumulering sjældent studeres i biofysik, viste de fluorescens-mærkede Cas12a-proteiner en tendens til at danne små ringlignende ophobninger, hvor øget lasereffekt øgede deres akkumuleringshastighed.
Holdet udførte desuden eksperimenter på almindeligt inkorporerede proteiner såsom bovint serumalbumin med FITC-mærkning. I nærvær af et optotermisk felt forblev denne proteinfordeling tilfældig og upåvirket af tilstedeværelsen af polyethylenglycolmolekyler.
CRISPR-drevne optotermiske nanotweezer (CRONT) til at identificere nukleotider
Chen og teamet bemærkede, hvordan det optotermiske felt forbundet med de CRISPR-drevne optotermiske nanotweezere (CRONT) gav en passende temperatur til CRISPR-baseret biodetektion med kapaciteten til at berige bionanopartikler til at detektere DNA ved ultralave koncentrationer, i stedet for Brownsk bevægelse alene, dvs. styret gennem detektion af diffusion.
Forskerne inkluderede CRISPR-12a-skemaet til at undersøge enkeltstrenget omgivende DNA. CRONT-systemet identificerede med succes DNA'er på enkeltmolekyleniveau for enkeltnukleotidpolymorfismer med høj sensitivitet og specificitet.
Outlook
På denne måde inkorporerede Jiajie Chen og kolleger diffusioforese og termo-osmotiske strømme i grænselaget af en optotermisk responsiv film for at vise en ny metode til at regulere CRISPR-drevne optotermiske nanoweezer på nanoskala.
Denne metode tillod den øjeblikkelige implementering af CRISPR-baseret biosensing med et ultralavt detektionsvolumen.
Optisk pincet er udstyret med DNA-identifikation gennem CRISPR-baserede biosensing-systemer som en vej til biomolekyleberigelse for at spalte CRISPR-komplekset. Sådanne CRISPR-drevne optotermiske nanotweezere eller CRONT-systemer har et enormt løfte om at fremme forståelsen af komplekse biologiske processer som en alsidig detektionssonde på tværs af biomedicinsk forskning, lægemiddelopdagelse og sygdomsdiagnostik.
Flere oplysninger: Jiajie Chen et al., CRISPR-drevne optotermiske nanotweezere:Diverse bio-nanopartikelmanipulation og enkeltnukleotididentifikation, Light:Science &Applications (2023). DOI:10.1038/s41377-023-01326-9
Journaloplysninger: Lys:Videnskab og applikationer
© 2023 Science X Network
 Varme artikler
Varme artikler
-
 X-Ray Vision:se plastikblandinger inde og ude(PhysOrg.com) -- To videnskabsmænd, der arbejder i Europa, har banet vejen for forbedret plastikelektronik ved at udtænke en teknik, der kan bruges til at tage billeder af plastikblandinger på nanoska
X-Ray Vision:se plastikblandinger inde og ude(PhysOrg.com) -- To videnskabsmænd, der arbejder i Europa, har banet vejen for forbedret plastikelektronik ved at udtænke en teknik, der kan bruges til at tage billeder af plastikblandinger på nanoska -
 Forskere udvikler metode til at sondere faseovergange i 2-D materialerKredit:CC0 Public Domain Faseovergange spiller en vigtig rolle i materialer. Imidlertid, i todimensionelle materialer, den mest berømte af dem er grafen, faseovergange kan være meget vanskelige at
Forskere udvikler metode til at sondere faseovergange i 2-D materialerKredit:CC0 Public Domain Faseovergange spiller en vigtig rolle i materialer. Imidlertid, i todimensionelle materialer, den mest berømte af dem er grafen, faseovergange kan være meget vanskelige at -
 Ruthenium regler for nye brændselscellerRice University-forskere har fremstillet en holdbar katalysator til højtydende brændselsceller ved at binde enkelte rutheniumatomer til grafen. Kredit:Chris Zhang/Rice University Rice University-f
Ruthenium regler for nye brændselscellerRice University-forskere har fremstillet en holdbar katalysator til højtydende brændselsceller ved at binde enkelte rutheniumatomer til grafen. Kredit:Chris Zhang/Rice University Rice University-f -
 Freshmen-niveau kemi løser opløselighedsmysteriet af grafenoxidfilmBilledet til venstre viser den pæne GO film, som gik i opløsning i vand. Den forurenede film til højre forbliver stabil. Et team ledet af Northwestern University fandt for nylig svaret på et mysti
Freshmen-niveau kemi løser opløselighedsmysteriet af grafenoxidfilmBilledet til venstre viser den pæne GO film, som gik i opløsning i vand. Den forurenede film til højre forbliver stabil. Et team ledet af Northwestern University fandt for nylig svaret på et mysti
- Nyt nanoteknologisamarbejde fører til gennembrud inden for kræftforskning
- Forskere peger på jalousi i det monogame sind
- Nanopartikler kan øge effektiviteten og reducere bivirkninger af allergisprøjter
- De tidligste dyr udviklede sig senere end antaget
- Washingtons glansløse snepakke vækker bekymring, især på den olympiske halvø
- Frosset i tiden:Glacial arkæologi på Norges tag


