Konstruktion af bakterier til at biosyntetisere indviklede proteinkomplekser
Proteinbure, der findes i mikrober, hjælper dets indhold med at klare det barske intracellulære miljø - en observation, der har mange bioteknologiske anvendelser. Tokyo Tech-forskere har for nylig udviklet en innovativ bioteknologisk tilgang, der bruger genetisk modificerede bakterier til at inkorporere proteinbure omkring proteinkrystaller. Denne in-celle biosyntesemetode producerer effektivt meget tilpassede proteinkomplekser, som kunne finde anvendelser som avancerede faste katalysatorer og funktionaliserede nanomaterialer.
I naturen kan proteiner samles og danne organiserede komplekser med utallige former og formål. Takket være de bemærkelsesværdige fremskridt inden for bioteknik i løbet af de sidste par årtier, kan forskere nu producere skræddersyede proteinsamlinger til specialiserede applikationer. For eksempel kan proteinbure begrænse enzymer, der fungerer som katalysatorer for en målrettet kemisk reaktion. På samme måde kan proteinkrystaller - strukturer sammensat af gentagne enheder af proteiner - tjene som stilladser til at syntetisere faste materialer med blottede funktionelle terminaler.
Det er imidlertid en udfordring at inkorporere (eller "indkapsle") fremmede proteiner på overfladen af en proteinkrystal. Syntetisering af proteinkrystaller, der indkapsler fremmede proteinsamlinger, har således været uhåndgribelig. Indtil videre findes der ingen effektive metoder til at nå dette mål, og de producerede typer af proteinkrystaller er begrænsede. Men hvad nu hvis bakterielle cellulære maskineri var svaret?
I en nylig undersøgelse rapporterede et forskerhold fra Tokyo Institute of Technology, herunder professor Takafumi Ueno, en ny in-celle-metode til at indkapsle proteinbure med forskellige funktioner på proteinkrystaller. Deres papir, udgivet i Nano Letters , repræsenterer et væsentligt gennembrud inden for proteinkrystalteknologi.
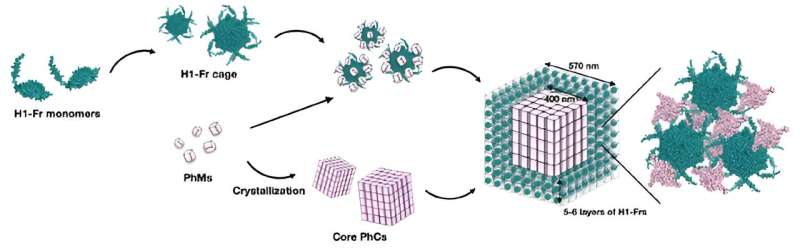
Holdets strategi involverer genetisk modificering af Escherichia coli-bakterier til at producere to hovedbyggesten:polyhedrinmonomer (PhM) og modificeret ferritin (Fr). På den ene side kombinerer PhM'er naturligt i celler for at danne en velundersøgt proteinkrystal kaldet polyederkrystal (PhC). På den anden side er 24 Fr-enheder kendt for at kombinere for at danne et stabilt proteinbur.
"Ferritin er blevet brugt i vid udstrækning som skabelon til at konstruere bio-nanomaterialer ved at modificere dets indre og ydre overflader. Så hvis dannelsen af et Fr-bur og dets efterfølgende immobilisering på PhC kan udføres samtidigt i en enkelt celle, vil anvendelserne af in-celle proteinkrystaller som bio-hybridmaterialer vil blive udvidet," forklarer prof. Ueno.
For at immobilisere Fr-burene i PhC modificerede forskerne genet, der koder for Fr, til at inkludere et α-helix(H1)-mærke af PhM, hvilket skaber H1-Fr. Begrundelsen bag denne tilgang er, at H1-helixerne, der er naturligt til stede i PhM-molekyler, interagerer signifikant med tags på H1-Fr, og fungerer som "rekruteringsmidler", der binder de fremmede proteiner til krystallen.
Ved hjælp af avancerede mikroskopi, analytiske og kemiske teknikker bekræftede forskerholdet gyldigheden af deres foreslåede tilgang. Gennem forskellige eksperimenter fandt de ud af, at de resulterende krystaller havde en kerne-skal struktur, nemlig en kubisk PhC kerne på omkring 400 nanometer bred dækket af fem eller seks lag H1-Fr bure.
Denne strategi for biosyntese af funktionelle proteinkrystaller lover meget for applikationer inden for medicin, katalyse og biomaterialeteknik. "H1-Fr bure har potentialet til at immobilisere eksterne molekyler inde i dem til molekylær levering," siger prof. Ueno.
"Vores resultater indikerer, at H1-Fr/PhC kerne-skal strukturerne, der viser H1-Fr bure på den ydre overflade af PhC kernen, kan styres individuelt på nanoskala niveau. Ved at akkumulere forskellige funktionelle molekyler i PhC kernen og H1 -Fr bur, hierarkiske nanoskala-kontrollerede krystaller kan konstrueres til avancerede bioteknologiske applikationer."
Fremtidige arbejde på dette område vil hjælpe os med at realisere det sande potentiale af bioteknologiske proteinkrystaller og samlinger. Med lidt held vil disse bestræbelser bane vejen for en sundere og mere bæredygtig fremtid.
Flere oplysninger: Thuc Toan Pham et al., Displaying a Protein Cage on a Protein Crystal af In-Cell Crystal Engineering, Nano Letters (2023). DOI:10.1021/acs.nanolett.3c02117
Leveret af Tokyo Institute of Technology
 Varme artikler
Varme artikler
-
 Forskere gør nanospinning praktiskEt lille udvalg af siliciumspidser klemt mellem elektroderne spinder ud af nanofibre af plastik, der kan være nyttige til en lang række applikationer. Kredit:Dominick Reuter Nanofibre - materiales
Forskere gør nanospinning praktiskEt lille udvalg af siliciumspidser klemt mellem elektroderne spinder ud af nanofibre af plastik, der kan være nyttige til en lang række applikationer. Kredit:Dominick Reuter Nanofibre - materiales -
 Forskere foreslår hurtig Ebola -test ved hjælp af nanoteknologiLigesom Ebola endelig var ved at falme fra overskrifterne, det kom tilbage i nyhederne med chokerende rapporter:en skotsk sygeplejerske genindlagt på hospitalet ni måneder efter at have slået Ebola, l
Forskere foreslår hurtig Ebola -test ved hjælp af nanoteknologiLigesom Ebola endelig var ved at falme fra overskrifterne, det kom tilbage i nyhederne med chokerende rapporter:en skotsk sygeplejerske genindlagt på hospitalet ni måneder efter at have slået Ebola, l -
 Forståelse af ladningsoverførsler i molekylær elektronikEnrique del Barcos arbejde vil bidrage til at fremme forståelsen af kvanteteknologier. Kredit:University of Central Florida Et internationalt forskerhold, som omfatter University of Central Flor
Forståelse af ladningsoverførsler i molekylær elektronikEnrique del Barcos arbejde vil bidrage til at fremme forståelsen af kvanteteknologier. Kredit:University of Central Florida Et internationalt forskerhold, som omfatter University of Central Flor -
 Forskere laver slalomkurser i nanoskala for elektronerIllustration af skitserede serpentin nanotråde lavet af lanthanaluminat og strontiumtitanat. Elektronernes side-til-side bevægelse, når de rejser, giver dem yderligere egenskaber, som kan bruges til a
Forskere laver slalomkurser i nanoskala for elektronerIllustration af skitserede serpentin nanotråde lavet af lanthanaluminat og strontiumtitanat. Elektronernes side-til-side bevægelse, når de rejser, giver dem yderligere egenskaber, som kan bruges til a
- Sådan konverteres tommer og pund til centimeter og kilogram
- Video:Antarktis opdagelsesrejsende og polarbiolog diskuterer et af historiens største isbjergbrud
- Skolesuspensioner relateret til stigninger i efterfølgende lovovertrædelser
- Sådan bruges Time Tracker From Highlights
- Hvorfor er destilleret vand en god kontrol for videnskabsprojekter?
- Tongue-in-cheek-pris med kultstatus for biografluftstudie


