Nanopore-teknologi opnår gennembrud inden for påvisning af proteinvarianter
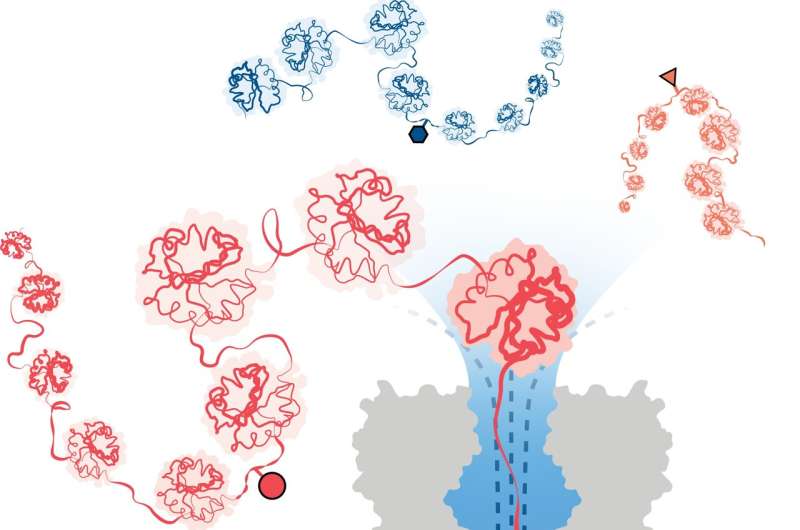
Et team af forskere ledet af University of Oxford har opnået et betydeligt gennembrud i at påvise ændringer på proteinstrukturer. Metoden, offentliggjort i Nature Nanotechnology , anvender innovativ nanopore-teknologi til at identificere strukturelle variationer på enkeltmolekyleniveau, selv dybt inde i lange proteinkæder.
Humane celler indeholder cirka 20.000 proteinkodende gener. Imidlertid er det faktiske antal proteiner observeret i celler langt større, med over 1.000.000 forskellige strukturer kendt. Disse varianter genereres gennem en proces kendt som post-translationel modifikation (PTM), som opstår efter et protein er blevet transskriberet fra DNA.
PTM introducerer strukturelle ændringer såsom tilføjelse af kemiske grupper eller kulhydratkæder til de individuelle aminosyrer, der udgør proteiner. Dette resulterer i hundredvis af mulige variationer for den samme proteinkæde.
Disse varianter spiller afgørende roller i biologien ved at muliggøre præcis regulering af komplekse biologiske processer i individuelle celler. Kortlægning af denne variation ville afdække et væld af værdifuld information, der kunne revolutionere vores forståelse af cellulære funktioner. Men til dato har evnen til at producere omfattende proteinbeholdninger forblevet et uhåndgribeligt mål.
For at overvinde dette har et hold ledet af forskere ved University of Oxfords Department of Chemistry med succes udviklet en metode til proteinanalyse baseret på nanopore DNA/RNA-sekventeringsteknologi. I denne tilgang fanger og udfolder en retningsbestemt strøm af vand 3D-proteiner til lineære kæder, der fødes gennem bittesmå porer, lige brede nok til, at et enkelt aminosyremolekyle kan passere igennem.
Strukturelle variationer identificeres ved at måle ændringer i en elektrisk strøm påført over nanoporen. Forskellige molekyler forårsager forskellige forstyrrelser i strømmen, hvilket giver dem en unik signatur.
Holdet demonstrerede med succes metodens effektivitet til at detektere tre forskellige PTM-modifikationer (phosphorylering, glutathionylering og glycosylering) på enkeltmolekyleniveau for proteinkæder på over 1.200 rester lange. Disse inkluderede modifikationer dybt inde i proteinets sekvens. Det er vigtigt, at metoden ikke kræver brug af etiketter, enzymer eller yderligere reagenser.
Ifølge forskerholdet kunne den nye proteinkarakteriseringsmetode let integreres i eksisterende bærbare nanopore-sekventeringsenheder for at gøre det muligt for forskere hurtigt at opbygge proteinbeholdninger af enkelte celler og væv. Dette kunne lette point-of-care diagnostik, hvilket muliggør personlig påvisning af specifikke proteinvarianter forbundet med sygdomme, herunder cancer og neurodegenerative lidelser.
Professor Yujia Qing (Kemiafdelingen, University of Oxford), medvirkende forfatter til undersøgelsen, sagde:"Denne enkle, men kraftfulde metode åbner op for adskillige muligheder. I starten giver den mulighed for undersøgelse af individuelle proteiner, såsom dem, der er involveret i specifikke sygdomme. På længere sigt rummer metoden potentialet til at skabe udvidede lagerbeholdninger af proteinvarianter i celler, hvilket åbner op for dybere indsigt i cellulære processer og sygdomsmekanismer."
Professor Hagan Bayley (Department of Chemistry, University of Oxford), bidragende forfatter og medstifter af Oxford Nanopore Technologies, tilføjede:"Evnen til at lokalisere og identificere post-translationelle modifikationer og andre proteinvariationer på enkeltmolekyleniveau lover enormt meget. for at fremme vores forståelse af cellulære funktioner og molekylære interaktioner Det kan også åbne nye veje for personlig medicin, diagnostik og terapeutiske interventioner."
Dette arbejde blev udført i samarbejde med mekanobiolog Sergi Garcia-Maynes forskergruppe ved King's College London og Francis Crick Institute.
Flere oplysninger: Pablo Martin-Baniandres et al., Enzymfri nanopore-detektion af post-translationelle modifikationer inden for lange polypeptider, Nature Nanotechnology (2023). DOI:10.1038/s41565-023-01462-8
Journaloplysninger: Naturenanoteknologi
Leveret af University of Oxford
 Varme artikler
Varme artikler
-
 Forskere kaprer kræftmigreringsmekanisme til at flytte hjernetumorerS. Balakrishna Pai, en forsker i laboratoriet hos Ravi Bellamkonda i Wallace H. Coulter Department of Biomedical Engineering ved Georgia Tech og Emory University, undersøger glioblastomcelleprøver. Kr
Forskere kaprer kræftmigreringsmekanisme til at flytte hjernetumorerS. Balakrishna Pai, en forsker i laboratoriet hos Ravi Bellamkonda i Wallace H. Coulter Department of Biomedical Engineering ved Georgia Tech og Emory University, undersøger glioblastomcelleprøver. Kr -
 Forskere udvikler atomskala hardware til at implementere naturlig computingEt atomskifte netværk, viser (a) arrayet af platinelektroder og (b) et SEM-billede af selvorganiserede sølv-nanotråde på et gitter af kobberpæle. Overlappende krydsninger af ledninger danner atomafbry
Forskere udvikler atomskala hardware til at implementere naturlig computingEt atomskifte netværk, viser (a) arrayet af platinelektroder og (b) et SEM-billede af selvorganiserede sølv-nanotråde på et gitter af kobberpæle. Overlappende krydsninger af ledninger danner atomafbry -
 Forstå kilden til ekstra store kapaciteter i lovende Li-ion batterielektroderEt resumé af tretrins reaktionsvej for rutheniumoxid-lithiumbatterisystemet. Lithium (Li) ion batterier driver næsten alle de bærbare elektroniske enheder, som vi bruger hver dag, herunder smartph
Forstå kilden til ekstra store kapaciteter i lovende Li-ion batterielektroderEt resumé af tretrins reaktionsvej for rutheniumoxid-lithiumbatterisystemet. Lithium (Li) ion batterier driver næsten alle de bærbare elektroniske enheder, som vi bruger hver dag, herunder smartph -
 Nanotwins, der er adskilt fra hinanden, skaber stærkere metallerNanotwins har vist sig at forbedre styrken og andre egenskaber ved metaller. En ny undersøgelse viser, at styrken kan forbedres yderligere ved at variere mængden af plads mellem nanotwins. Kredit:Ga
Nanotwins, der er adskilt fra hinanden, skaber stærkere metallerNanotwins har vist sig at forbedre styrken og andre egenskaber ved metaller. En ny undersøgelse viser, at styrken kan forbedres yderligere ved at variere mængden af plads mellem nanotwins. Kredit:Ga
- Virus spil Plague app trukket i Kina:udvikler
- Indfødt landsby foreslår ny mulighed for at genoprette Eklutna-floden
- At skubbe studiet af ikke-kovalente intermolekylære interaktioner ind i et nyt område
- Israelsk hold undersøger begivenhedskæden i månestyrt
- Små sonder skinner kraftigt for at afsløre placeringen af målrettede væv
- De menneskelige omkostninger ved udvikling af palmeolie


