Kunstig fotosyntese med konstruktion af proteinkrystaller i bakterier
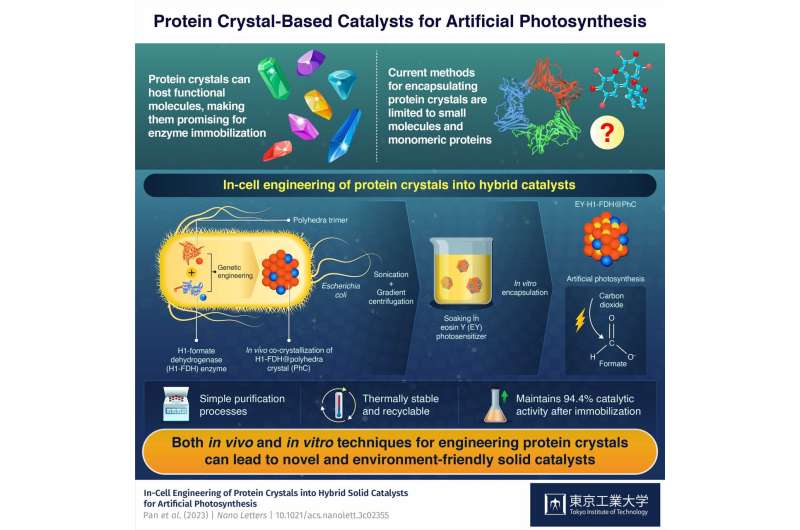
In-cell engineering kan være et kraftfuldt værktøj til at syntetisere funktionelle proteinkrystaller med lovende katalytiske egenskaber, viser forskere ved Tokyo Tech. Ved at bruge genetisk modificerede bakterier som en miljøvenlig synteseplatform producerede forskerne hybride faste katalysatorer til kunstig fotosyntese. Disse katalysatorer udviser høj aktivitet, stabilitet og holdbarhed, hvilket fremhæver potentialet i den foreslåede innovative tilgang.
Proteinkrystaller er ligesom almindelige krystaller velordnede molekylære strukturer med forskellige egenskaber og et enormt potentiale for tilpasning. De kan samles naturligt af materialer, der findes i celler, hvilket ikke kun reducerer synteseomkostningerne markant, men også mindsker deres miljøpåvirkning.
Selvom proteinkrystaller er lovende som katalysatorer, fordi de kan være vært for forskellige funktionelle molekyler, muliggør nuværende teknikker kun vedhæftning af små molekyler og simple proteiner. Det er således bydende nødvendigt at finde måder at producere proteinkrystaller, der bærer både naturlige enzymer og syntetiske funktionelle molekyler for at udnytte deres fulde potentiale for enzymimmobilisering.
På denne baggrund har et team af forskere fra Tokyo Institute of Technology (Tokyo Tech) under ledelse af professor Takafumi Ueno udviklet en innovativ strategi til at producere hybride faste katalysatorer baseret på proteinkrystaller. Som forklaret i deres papir offentliggjort i Nano Letters den 12. juli 2023 kombinerer deres tilgang in-cell engineering og en simpel in vitro proces til at producere katalysatorer til kunstig fotosyntese.
Byggestenen i hybridkatalysatoren er en proteinmonomer afledt af en virus, der inficerer Bombyx mori silkeormen. Forskerne introducerede genet, der koder for dette protein i Escherichia coli-bakterier, hvor de producerede monomerer dannede trimerer, der igen spontant samlede sig til stabile polyederkrystaller (PhC'er) ved at binde sig til hinanden gennem deres N-terminale α-helix (H1) ).
Derudover introducerede forskerne en modificeret version af formiatdehydrogenase-genet (FDH) fra en gærart i E. coli-genomet. Dette gen fik bakterierne til at producere FDH-enzymer med H1-terminaler, hvilket førte til dannelsen af hybride H1-FDH@PhC-krystaller i cellerne.
Holdet ekstraherede hybridkrystallerne ud af E. coli-bakterierne gennem sonikering og gradientcentrifugering og gennemblødte dem i en opløsning indeholdende en kunstig fotosensibilisator kaldet eosin Y (EY). Som et resultat heraf lettede proteinmonomererne, som var blevet genetisk modificeret, således at deres centrale kanal kunne være vært for et eosin Y-molekyle, den stabile binding af EY til hybridkrystallen i store mængder.
Gennem denne geniale proces lykkedes det teamet at producere yderst aktive, genanvendelige og termisk stabile EY·H1-FDH@PhC-katalysatorer, der kan omdanne kuldioxid (CO2 ) til format (HCOO − ) ved udsættelse for lys, der efterligner fotosyntese. Derudover bibeholdt de 94,4 % af deres katalytiske aktivitet efter immobilisering sammenlignet med det frie enzyms.
"Konverteringseffektiviteten af den foreslåede hybridkrystal var en størrelsesorden højere end den af tidligere rapporterede forbindelser til enzymatisk kunstig fotosyntese baseret på FDH," siger prof. Ueno. "Desuden forblev hybrid-phc'en i den faste protein-samlingstilstand efter at have gennemgået både in vivo- og in vitro-tekniske processer, hvilket demonstrerede den bemærkelsesværdige krystalliseringskapacitet og stærke plasticitet af PhC'er som indkapslende stilladser."
Samlet set viser denne undersøgelse potentialet af bioingeniør til at lette syntesen af komplekse funktionelle materialer. "Kombinationen af in vivo og in vitro teknikker til indkapsling af proteinkrystaller vil sandsynligvis give en effektiv og miljøvenlig strategi for forskning inden for områderne nanomaterialer og kunstig fotosyntese," konkluderer prof. Ueno.
Flere oplysninger: Tiezheng Pan et al., In-Cell Engineering of Protein Crystals into Hybrid Solid Catalysts for Artificial Photosynthesis, Nano Letters (2023). DOI:10.1021/acs.nanolett.3c02355
Journaloplysninger: Nano-bogstaver
Leveret af Tokyo Institute of Technology
 Varme artikler
Varme artikler
-
 Resonant energioverførsel fra kvantepunkter til grafenSkematisk af en nanofotonisk enhed med quantum dot-graphene, som beskrevet i dette forskningsprojekt. Halvlederkvantumpunkter (QDer) er halvledere i nanoskala, der udviser størrelsesafhængige fysi
Resonant energioverførsel fra kvantepunkter til grafenSkematisk af en nanofotonisk enhed med quantum dot-graphene, som beskrevet i dette forskningsprojekt. Halvlederkvantumpunkter (QDer) er halvledere i nanoskala, der udviser størrelsesafhængige fysi -
 Ny katalysator giver mere nøjagtig PSA-testEn ny katalysator, der forbedrer følsomheden af standard PSA-testen mere end 100 gange, afbilledet ovenfor, er lavet af palladium nanokuber belagt med iridium. Sig, at du er blevet diagnosticere
Ny katalysator giver mere nøjagtig PSA-testEn ny katalysator, der forbedrer følsomheden af standard PSA-testen mere end 100 gange, afbilledet ovenfor, er lavet af palladium nanokuber belagt med iridium. Sig, at du er blevet diagnosticere -
 Forskere forbedrer computermodellering til design af nanobærere til lægemiddelleveringForskernes nye model tager højde for, hvordan cytoskeletal pinning påvirker bølgerne i en celles membran. Kredit:University of Pennsylvania Et hold forskere fra University of Pennsylvania har udvi
Forskere forbedrer computermodellering til design af nanobærere til lægemiddelleveringForskernes nye model tager højde for, hvordan cytoskeletal pinning påvirker bølgerne i en celles membran. Kredit:University of Pennsylvania Et hold forskere fra University of Pennsylvania har udvi -
 Tuning af en magnetisk væske med et elektrisk felt skaber kontrollerbare dissipative mønstreFotografier og mikrofotografier, der viser de forskellige mønstre udstillet af elektroferrofluiden:ligevægtsmønstre kun i magnetfelt (venstre) og ikke-ligevægtsmønstre skabt under en kombination af el
Tuning af en magnetisk væske med et elektrisk felt skaber kontrollerbare dissipative mønstreFotografier og mikrofotografier, der viser de forskellige mønstre udstillet af elektroferrofluiden:ligevægtsmønstre kun i magnetfelt (venstre) og ikke-ligevægtsmønstre skabt under en kombination af el
- Ingeniører løser energipuslespil
- On the dot:Ny kvantesensor giver ny tilgang til tidlig diagnose via billeddannelse
- Ny nøglebeskyttelse mod COVID-19 fundet i spyt
- Forskere udvikler nyt transistorkoncept
- Gørt ved havet, Australien står over for en alvorlig klimaudfordring
- Bærbart miljøkammer licenseret til FOM-teknologier


