En ny type superopløsning til at udforske celledeling
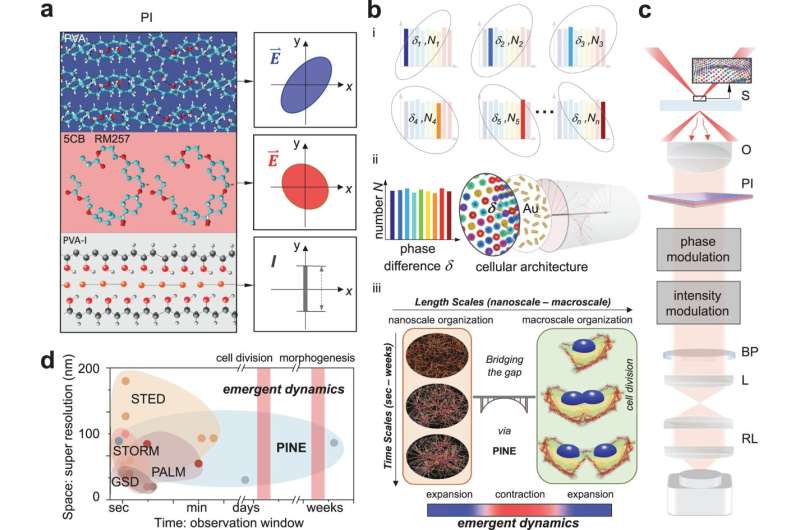
En ny måde at se detaljer, der er mindre end halvdelen af lysets bølgelængde, har afsløret, hvordan stilladser i nanoskala inde i celler slår bro til makroskalaen under celledeling. I modsætning til tidligere superopløsningsteknikker er den, der er udviklet og testet ved University of Michigan, ikke afhængig af molekyler, der slides ved længere tids brug.
Superopløsning kan afsløre strukturer ned til 10 nanometer, eller omtrent samme bredde som 100 atomer. Det åbnede en helt ny verden inden for biologi, og de teknikker, der først gjorde det muligt, fik en Nobelpris i 2014. Dens svaghed er dog, at den kun kan tage snapshots over snesevis af sekunder. Dette gør det umuligt at observere udviklingen af en celles maskineri over lange perioder.
"Vi undrede os - når systemet som helhed deler sig, hvordan interagerer strukturer i nanometerskala med deres naboer på nanometerskalaen, og hvordan skalerer denne interaktion op til hele cellen?" spurgte Somin Lee, UM-assistentprofessor i elektro- og computerteknik, som ledede undersøgelsen offentliggjort i Nature Communications .
For at besvare det spørgsmål havde Lee og kolleger brug for en ny form for superopløsning. Ved hjælp af deres nye metode var de i stand til kontinuerligt at overvåge en celle i 250 timer.
"Den levende celle er et travlt sted med proteiner, der myldrer her og der. Vores superopløsning er meget attraktiv til at se disse dynamiske aktiviteter," sagde Guangjie Cui, en Ph.D. studerende i elektro- og computerteknik og medførsteforfatter på studiet sammen med Yunbo Liu, en ph.d. kandidat i elektro- og computeringeniør.
Ligesom den originale metode bruger den nye teknik sonder i nærheden af de interessante nanoskalaobjekter til at kaste lys over dem. Superresolution 1.0 brugte fluoroforer til dette, fluorescerende molekyler, der ville sende et svarlys ud efter at være blevet belyst. Hvis fluoroforerne var tættere på hinanden end størrelsen af det, der blev afbildet, kunne billedet rekonstrueres ud fra lysudbruddene produceret af fluoroforerne.
Den nye teknik bruger guld nanorods, som ikke nedbrydes ved gentagen eksponering for lys, men det er mere udfordrende at bruge det lys, der interagerer med dem. Nanorods reagerer på lysets fase, eller hvor det er i op-og-ned-oscillationen af de elektriske og magnetiske felter, der udgør det. Denne interaktion afhænger af, hvordan nanorod er vinklet til det indkommende lys.
Ligesom fluoroforerne kan nanoroderne binde sig til bestemte cellestrukturer med målrettede molekyler på deres overflader. I dette tilfælde søgte nanoroderne efter actin, et protein, der tilføjer struktur til bløde celler. Actin er formet som forgrenede filamenter, hver omkring 7 nanometer (milliontedele af en millimeter) i diameter, selvom de forbinder hinanden for at spænde over tusindvis af nanometer. Selvom nanoroderne ofte er mere end dobbelt så store som actinets diameter, kan de data, de leverer som en gruppe, belyse dens små detaljer.
For at lokalisere nanoroderne byggede teamet filtre lavet af tynde lag af polymerer og flydende krystaller. Disse filtre muliggjorde detektering af lys med en bestemt fase, hvilket gjorde det muligt for holdet at udvælge nanorods med bestemte vinkler til det indkommende lys. Ved at tage 10-30 billeder - hver ser på en anden undergruppe af nanorods - og flette dem sammen til et enkelt billede, var holdet i stand til at udlede detaljerne i nanometerskalaen af filamenterne inde i cellerne. Disse detaljer ville blive sløret i konventionelle mikroskoper.
Ved hjælp af teknikken opdagede holdet tre regler, der styrer den måde, hvorpå actin selvorganiserer sig under celledeling:
- Actin udvider sig for at nå sine naboer, når actinfilamenter er langt fra hinanden.
- Actin vil komme tættere på sine naboer for at øge forbindelserne, selvom denne tendens dæmpes af driften til at udvide og nå flere naboer.
- Som et resultat har actin-netværket en tendens til at trække sig sammen, når det er mere forbundet, og det vil udvide sig, når det er mindre forbundet.
Aktinets adfærd er forbundet med cellens adfærd - men cellen trækker sig sammen, når aktinet udvider sig, og det udvider sig, når aktinet trækker sig sammen. Holdet ønsker at udforske dette yderligere og opdage, hvorfor bevægelserne er modsatte på forskellige skalaer. De ønsker også at undersøge konsekvenserne af dysregulering af denne molekylære proces:Er det roden til nogle sygdomme?
Mere generelt håber de at bruge superopløsning til at forstå, hvordan selvorganisering er indbygget i biologiske strukturer uden behov for central kontrol.
"Vores genetiske kode indeholder faktisk ikke nok information til at kode alle detaljer i organisationsprocessen," sagde Lee. "Vi ønsker at udforske mekanismerne for kollektiv adfærd uden central koordination, der er som fugle, der flyver i formation - hvor systemet er drevet af interaktioner mellem individuelle dele."
Flere oplysninger: Guangjie Cui et al., Phase intensity nanoscope (PINE) åbner langtidsundersøgelsesvinduer for levende stof, Nature Communications (2023). DOI:10.1038/s41467-023-39624-w
Journaloplysninger: Nature Communications
Leveret af University of Michigan
Sidste artikelForskere sætter et nyt twist på grafit
Næste artikelLysere fluorescerende markører giver mulighed for finere billeddannelse
 Varme artikler
Varme artikler
-
 Vores sundhed:Nyt fokus på synergieffekten af nanopartiklerKredit:CC0 Public Domain Nanopartikler bruges i en lang række produkter og fremstillingsprocesser, fordi et materiales egenskaber kan ændre sig dramatisk, når materialet kommer i nanoform. De kan
Vores sundhed:Nyt fokus på synergieffekten af nanopartiklerKredit:CC0 Public Domain Nanopartikler bruges i en lang række produkter og fremstillingsprocesser, fordi et materiales egenskaber kan ændre sig dramatisk, når materialet kommer i nanoform. De kan -
 Forskere bruger enkle, lavpris laserteknik til forbedring af nanomaterialers egenskaber og funktione…Mesoporøse silicium -nanotråde blev scannet af en fokuseret laserstråle i to forskellige mønstre, afbildet af lysfelt optisk mikroskop, som vist ved (a) og (c), samt fluorescensmikroskopi, som afbilde
Forskere bruger enkle, lavpris laserteknik til forbedring af nanomaterialers egenskaber og funktione…Mesoporøse silicium -nanotråde blev scannet af en fokuseret laserstråle i to forskellige mønstre, afbildet af lysfelt optisk mikroskop, som vist ved (a) og (c), samt fluorescensmikroskopi, som afbilde -
 1 + 1 er ikke lig med 2 for grafenlignende 2-D materialerKredit:CC0 Public Domain Fysikere fra University of Sheffield har opdaget, at når to atomisk tynde grafenlignende materialer placeres oven på hinanden, ændres deres egenskaber, og et materiale med
1 + 1 er ikke lig med 2 for grafenlignende 2-D materialerKredit:CC0 Public Domain Fysikere fra University of Sheffield har opdaget, at når to atomisk tynde grafenlignende materialer placeres oven på hinanden, ændres deres egenskaber, og et materiale med -
 Eksperimenter viser, hvordan memristorer fungererDenne animation viser, hvordan millioner af højspændingsskiftecyklusser kan få memristorer til at svigte. Højspændingsomskiftningen skaber i sidste ende områder, der er permanent rige (blå gruber) ell
Eksperimenter viser, hvordan memristorer fungererDenne animation viser, hvordan millioner af højspændingsskiftecyklusser kan få memristorer til at svigte. Højspændingsomskiftningen skaber i sidste ende områder, der er permanent rige (blå gruber) ell
- Californien accepterer at udsætte håndhævelsen af netneutralitetsloven
- Entropi forklarer RNA -diffusionshastigheder i celler
- Gennemgang af evalueringer af Project Safe Neighborhoods-programmer identificerer huller i litteratu…
- Ny teknik forudser hurtigt sårbarhed ved saltmose
- Holdet gennemgår phosphinligand-induceret strukturel transformation af metal nanoclusters
- Forskere opretter genopladelige svømmemikrorobotter ved hjælp af olie og vand


