Hvordan vil den amerikanske bioteknologiindustri drage fordel af nye patentlove?
1. First-to-File System :AIA skiftede det amerikanske patentsystem fra et "first-to-invent" til et "first-to-file"-system. Det betyder, at den første opfinder, der indgiver en patentansøgning for en opfindelse, vil få patentet i stedet for den første opfinder, der rent faktisk opfinder teknologien. Denne ændring er især fordelagtig for bioteknologiske virksomheder, da den tilskynder til tidlig indgivelse af patentansøgninger og hjælper med at sikre patentrettigheder til innovative teknologier inden for et felt i hastig udvikling.
2. Udløbsperiode :AIA indførte en etårig henstandsperiode efter offentlig offentliggørelse af en opfindelse, i hvilket tidsrum opfinderen stadig kan indgive en patentansøgning og påberåbe sig prioritet til den tidligere offentliggørelse. Denne bestemmelse giver bioteknologivirksomheder større fleksibilitet til at offentliggøre deres innovationer på videnskabelige konferencer eller gennem publikationer uden at bringe deres patentrettigheder i fare.
3. Inter Partes Review (IPR) og Post-Grant Review (PGR) :AIA etablerede nye efter-tildelingsrevisionsprocedurer, herunder IPR og PGR, som giver tredjeparter mulighed for at anfægte gyldigheden af udstedte patenter. IPR'er kan indgives inden for et år efter patentudstedelse, mens PGR'er kan indgives inden for ni måneder efter patentudstedelse. Disse procedurer giver bioteknologivirksomheder mulighed for at forsvare gyldigheden af deres patenter mod udfordringer eller ugyldiggøre patenter, som er indeholdt af konkurrenter.
4. Biosimilars Pathway :AIA skabte en forkortet godkendelsesvej for biosimilarer, som er biologiske lægemidler, der i høj grad ligner et eksisterende FDA-godkendt biologisk lægemiddel (kendt som referenceproduktet). Denne vej gør det muligt for producenter af biosimilarer at demonstrere lighed med referenceproduktet gennem sammenlignende undersøgelser i stedet for at udføre omfattende kliniske forsøg, og derved fremskynde godkendelsesprocessen for biosimilarer. Godkendelsen af biosimilars kan indføre konkurrence og presse omkostningerne til biologiske lægemidler ned, hvilket kan gavne både patienter og sundhedsvæsen.
5. Pædiatrisk eksklusivitet :AIA forlængede eksklusivitetsperioden for pædiatriske undersøgelser af visse lægemidler og biologiske lægemidler fra seks måneder til seks år. Denne udvidelse giver et incitament for bioteknologiske virksomheder til at udføre pædiatriske undersøgelser, hvilket kan føre til sikrere og mere effektive behandlinger for børn.
Samlet set introducerede AIA adskillige ændringer til det amerikanske patentsystem, der er designet til at fremme innovation, tilskynde til tidlig indgivelse af patentansøgninger, give større fleksibilitet til offentlig offentliggørelse, lette udfordringen og forsvaret af patenter, fremme udviklingen af biosimilarer og støtte pædiatrisk undersøgelser. Disse bestemmelser forventes at have en positiv indvirkning på den amerikanske bioteknologiindustri ved at give en mere understøttende og forudsigelig juridisk ramme for innovation og kommercialisering.
 Varme artikler
Varme artikler
-
 Inkorporering af biofunktionalitet i nanomaterialer til medicinsk, sundhedsudstyrDette scanningselektronmikrofotografi blev opnået fra en zinkoxidbelagt nanoporøs aluminiumoxidmembran. Kredit:Dr. Roger Narayan, North Carolina State University Et hold ledet af forskere fra Nort
Inkorporering af biofunktionalitet i nanomaterialer til medicinsk, sundhedsudstyrDette scanningselektronmikrofotografi blev opnået fra en zinkoxidbelagt nanoporøs aluminiumoxidmembran. Kredit:Dr. Roger Narayan, North Carolina State University Et hold ledet af forskere fra Nort -
 Termiske gradienter vist at forbedre spintransport i grafenKredit:Catalan Institute of Nanoscience and Nanotechnology Forskere fra ICN2 Physics and Engineering of Nanodevices Group, ledet af ICREA Prof. Sergio O. Valenzuela, har bidraget til litteraturen
Termiske gradienter vist at forbedre spintransport i grafenKredit:Catalan Institute of Nanoscience and Nanotechnology Forskere fra ICN2 Physics and Engineering of Nanodevices Group, ledet af ICREA Prof. Sergio O. Valenzuela, har bidraget til litteraturen -
 Sidekick-mikrobobler bærer lægemidler mod kræft, beskadiger tumorkarMikrobobler kan hjælpe med lokaliseret lægemiddellevering i en patients krop ved at poppe på et målsted for at skabe øget permeabilitet af tumorblodkar. Kredit:Naomi Matsuura, University of Toronto
Sidekick-mikrobobler bærer lægemidler mod kræft, beskadiger tumorkarMikrobobler kan hjælpe med lokaliseret lægemiddellevering i en patients krop ved at poppe på et målsted for at skabe øget permeabilitet af tumorblodkar. Kredit:Naomi Matsuura, University of Toronto -
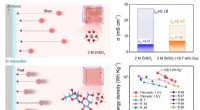 Almindelig spisesukkernøgle til at afhjælpe sikkerhedsproblemer i vandige zinkbatterierForskere designet en saccharose-modificeret vandig elektrolyt, der øger mobiliteten af zinkion som reaktion på det elektriske felt og med succes opnår dendritfri zinkbatterier uden at gå på kompromi
Almindelig spisesukkernøgle til at afhjælpe sikkerhedsproblemer i vandige zinkbatterierForskere designet en saccharose-modificeret vandig elektrolyt, der øger mobiliteten af zinkion som reaktion på det elektriske felt og med succes opnår dendritfri zinkbatterier uden at gå på kompromi
- Puerto Rico online-svindel rettet mod mere end $4 millioner midt i krise
- Hvordan St. Louis Arch står over for alle odds
- Hvordan økonomisk teori og Netflix-prisen kunne gøre forskningsfinansiering mere effektiv
- Cryo-EM-billeddannelse antyder, hvordan den dobbelte helix adskilles under replikation
- Forskere finder jernsne i Jordens kerne
- Sydney indfører første vandrestriktioner i årti


