Sådan læses protein elektroforese
Natriumdodecylsulfat-polyacrylamidgelelektroforese (SDS-PAGE) er en biokemisk metode til identifikation af proteiner i opløsning. Som illustreret af Mathews et al i "Biochemistry" indlæses proteinprøver først i "brønde" eller huller i den ene ende af polyacrylamidgelblokken. Et elektrisk felt påføres derefter på gelen. SDS, tilsat til de ladede prøver, negerer den naturlige ladning af proteiner. Af denne grund bestemmer proteinmolekylvægt alene migrationshastigheden af proteiner, når de bevæger sig gennem gelen mod den positivt ladede pol, noter Bitesize Bio. Flere proteiner i samme prøve vil derfor skille fra hinanden og overføre til forskellige positioner.
Orienter gelfotografiet. "Top" er placeringen af brøndene, hvor prøverne oprindeligt blev tilføjet. "Bund" er, hvor prøverne migrerede mod og oftest indeholder farvestoffronten, der angiver prøvens migrerende front. Enten skal venstre eller højre indeholde en "markør", der anvendes som en forudsigelig molekylvægt guide.
Mærk prøverne for hver bane. På tværs af toppen vil de prøver, der føjes til brøndene, have migreret lodret i "baner". Derfor kom alle søjlerne, der var synlige i en lodret søjle, fra den ene prøve, der blev lagt direkte over den. Brug linjal og pen til at sætte grænser på banerne, hvis det er svært at visualisere kolonner.
Mærk de molekylære størrelser af båndene i markørbanen. Kommercielt tilgængelige markører kommer med et billede af båndmønsteret at forvente sammen med molekylvægten af hvert bånd. Bånd er de mørke horisontale "barer", som faktisk er farvet protein, der er indlejret i gelen.
Tegn lette vandrette linjer, der strækker sig ud fra hvert markørbånd til den modsatte kant af gelen. Pas på at gøre disse linjer parallelle med brøndene og til farvestoffronten. Disse linjer indikerer, hvor proteiner af molekylvægten angivet ved hver af markørbåndene ville være placeret i hver bane. For eksempel vil et bånd i bane 4, der ligger lige under linjen forlænget fra 25-kilodaltonmarkørbåndet, tyde på, at bane 4 båndet er næsten men ikke helt 25 kilodalton i molekylvægt.
Mærk hvert bånd i hver bane med sin estimerede molekylvægt. Brug markørerne som vejledning, og estimér værdier mellem markørstørrelser.
Lav et billede af "proteiner" for hver bane under gelbilledet. Begynd med at angive, hvad der er kendt om hver prøve, såsom dets oprindelse eller betingelser. Angiv derefter den estimerede molekylvægt af hvert bånd i banen. Baner med et bånd indikerer, at prøven kun indeholder et protein. Baner med flere bånd indikerer tilstedeværelsen af flere proteiner. Bånd, der kører med migrationsfronten, er mindre end foreslået af nærmeste markør, og sandsynligvis kan ikke forudsiges, medmindre som "mindre end" markøren angiver.
I proteinlisten skal du notere oddities. Et "udsmeltet" udseende kan indikere, at der er for mange proteiner til stede, eller at prøvenes viskositet påvirker dens migration. Hvis bånd ser ud til at gå ud over kanten af banen eller er ret store sammenlignet med andre bånd, så er koncentrationen af proteinet sandsynligvis for høj og bør fortyndes i fremtidig elektroforese. En gråagtig farvetone i hele bane, mørkere end baggrundsgelens farve, indikerer uundgåelige proteinfragmenter.
Bestem proteinernes identitet i hver bane. Selvom dette er gjort ved hjælp af kun molekylvægt, vil kilden til hver bane sandsynligvis indikere spor også. Overvej at proteiner under visse betingelser kan opretholde en dimer eller trimer association på en gel. Derfor kan et protein forekomme på en gel som tre forskellige bånd. Selvom proteiner ikke kan identificeres, kan båndets relative mørke betyde koncentrationerne af proteinerne i opløsning. Eventuelle nysgerrige og ukendte proteiner kan isoleres direkte fra den oprindelige gel og sendes til identifikation.
Sidste artikelHvad er nogle gode DNA-videnskabsprojekter?
Næste artikelSådan laver du en 3D-model Plantecelle uden Food
 Varme artikler
Varme artikler
-
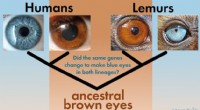 Konvergent udvikling:Når en god idé bevæger sig mellem arterKonvergent udvikling ses ved fremkomsten af blå øjenfarve i primater. Wikimedia Commons (CC BY-SA 2.5)/HowStuffWorks Har du nogensinde bemærket, at guldsmede, flagermus og californiske kondorer har
Konvergent udvikling:Når en god idé bevæger sig mellem arterKonvergent udvikling ses ved fremkomsten af blå øjenfarve i primater. Wikimedia Commons (CC BY-SA 2.5)/HowStuffWorks Har du nogensinde bemærket, at guldsmede, flagermus og californiske kondorer har -
 Anvendelse af mikroskoper i ScienceMikroskopet bruges i en række videnskabelige områder til mange forskellige formål. Uanset om det drejer sig om retsmedicin eller traditionel medicinsk videnskab, er mikroskopet et uundværligt instrume
Anvendelse af mikroskoper i ScienceMikroskopet bruges i en række videnskabelige områder til mange forskellige formål. Uanset om det drejer sig om retsmedicin eller traditionel medicinsk videnskab, er mikroskopet et uundværligt instrume -
 10 misforståelser om influenzaChefapoteket Ali A. Yasin (til venstre) giver influenzaoplysninger til Juan Castro (højre) efter at have givet ham influenzavaccinen i New York. De ældre er mere sårbare end de unge over for influenza
10 misforståelser om influenzaChefapoteket Ali A. Yasin (til venstre) giver influenzaoplysninger til Juan Castro (højre) efter at have givet ham influenzavaccinen i New York. De ældre er mere sårbare end de unge over for influenza -
 Hvad adskiller mennesker fra chimpanser og andre aber?Hvad adskiller virkelig et menneskebarn fra den elskede chimpanse? Se flere billeder af pattedyr. Tambako Jaguar/Getty Images Mennesker ser sig selv i alt. Vi etablerer følelsesmæssige forbindelser t
Hvad adskiller mennesker fra chimpanser og andre aber?Hvad adskiller virkelig et menneskebarn fra den elskede chimpanse? Se flere billeder af pattedyr. Tambako Jaguar/Getty Images Mennesker ser sig selv i alt. Vi etablerer følelsesmæssige forbindelser t


