Sådan beregnes Kf
Hvis du nogensinde har lavet is med en gammeldags churn, har du set frysepunktsdepression - betegnet Tf - i aktion. Frysepunktdæmpning er tilsætningen af et opløst stof for at sænke frysepunktet for en opløsning. I eksempelet på iskernen tilsættes salt til knust is, som bringer opløsningen under nul grader Celcius og giver den søde creme frysning. For at beregne frysepunktsdepressionskonstanten eller Kf skal du bruge ligningen: delta Tf = Kfcm hvor cm er opløsningens molalkoncentration.
Skriv ned, hvad du kender. Da Kf er en konstant eller et tal, der altid er det samme, er det ofte angivet i et diagram eller et bord i kemibøger. Hvis du ikke ser en Kf-værdi, der er angivet i problemet, skal du vende tilbage til bogen og søge efter en Kf-tabel i bilagene. Du behøver muligvis ikke at beregne en værdi for dig selv.
Skriv om ligningen. Hvis Kf ikke leveres, skal du løse det med en revideret frysepunkt-depressionligning. Opdel frysestedsdepression med molalkoncentrationen, så du har: Kf = delta Tf /cm.
Indsæt værdierne for delta Tf og cm. Hvis du f.eks. Har en opløsning med en molalitet på 0,455, som fryser ved 3,17 grader Celsius, vil Kf være 3,17 divideret med 0,455 eller 6,96 grader Celsius.
TL; DR (for lang tid, ikke læst )
Kemiske problemer kræver ofte mere end en ligning. For eksempel skal du muligvis beregne molalitet, før du kan sætte den i frysepunktsdepression. Molalitet er lig med mængden af opløst stof i mol over opløsningsmidlets masse i kg.
 Varme artikler
Varme artikler
-
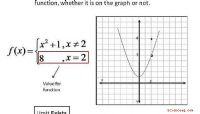 Sådan bestemmes om en grænse eksisterer ved en funktionsgrafVi vil bruge nogle eksempler på funktioner og deres grafer til at vise, hvordan vi kan afgøre, om grænsen eksisterer, når x nærmer sig et bestemt tal. Der findes fire forskellige måder at afgøre, om
Sådan bestemmes om en grænse eksisterer ved en funktionsgrafVi vil bruge nogle eksempler på funktioner og deres grafer til at vise, hvordan vi kan afgøre, om grænsen eksisterer, når x nærmer sig et bestemt tal. Der findes fire forskellige måder at afgøre, om -
 Sådan arbejder du med mikrobiologi FortyndingsproblemerFortyndinger er nyttige i videnskaben, når der laves løsninger eller vokser et acceptabelt antal bakteriekolonier at tælle. Der findes tre formler til at arbejde med mikrobiologiske fortyndingsproblem
Sådan arbejder du med mikrobiologi FortyndingsproblemerFortyndinger er nyttige i videnskaben, når der laves løsninger eller vokser et acceptabelt antal bakteriekolonier at tælle. Der findes tre formler til at arbejde med mikrobiologiske fortyndingsproblem -
 Børnehaveaktiviteter for volumenUndervisning af matematiske begreber som volumen til børnehavebørn er bedst opnået ved hjælp af ægte objekter, også kaldet manipulativer. Børn i denne alder har en naturlig nysgerrighed og bruger dere
Børnehaveaktiviteter for volumenUndervisning af matematiske begreber som volumen til børnehavebørn er bedst opnået ved hjælp af ægte objekter, også kaldet manipulativer. Børn i denne alder har en naturlig nysgerrighed og bruger dere -
 Sådan bruges TouchMathTouchMath er et multisensorielt matematikprogram designet til før-K gennem tredje klasse. Programmet hjælper med at gøre matematiske koncepter nemmere og mere tilgængelige for studerende med forskelli
Sådan bruges TouchMathTouchMath er et multisensorielt matematikprogram designet til før-K gennem tredje klasse. Programmet hjælper med at gøre matematiske koncepter nemmere og mere tilgængelige for studerende med forskelli


