Hvad opdagede videnskabsmand Antoine Lavoisier?
* Lov om bevarelse af masse: Denne grundlæggende lov siger, at den samlede masse af reaktanterne før en kemisk reaktion i et lukket system skal svare til den samlede masse af produkterne efter reaktionen. Lavoisiers eksperimenter med forbrænding demonstrerede omhyggeligt dette princip og revolutionerede forståelsen af kemiske reaktioner.
* iltrolle i forbrænding: Lavoisier udfordrede den langvarige phlogiston-teori om forbrænding, hvor han sagde, at et stof kaldet Phlogiston blev frigivet, da der blev brændt noget. Han viste, at forbrænding faktisk involverer reaktionen af et stof med ilt, hvilket beviser, at ilt er afgørende for ild.
* Nomenklatur af kemi: Lavoisier skabte sammen med kolleger et nyt system med kemisk nomenklatur, der gav klare og konsistente navne på kemiske elementer og forbindelser, der lå grundlaget for moderne kemisk terminologi.
* Opdagelse af elementer: Han genkendte og navngav flere kemiske elementer, herunder brint, ilt, nitrogen og fosfor.
* undersøgelse af respiration: Lavoisier undersøgte også respirationsprocessen og demonstrerede, at det i det væsentlige er en forbrændingsproces, hvor ilt forbruges og kuldioxid frigøres.
Disse opdagelser etablerede sammen med hans metodiske tilgang til eksperimentering og omhyggelig dataregistrering Lavoisier som en pioner inden for udviklingen af moderne kemi. Hans arbejde omdannede feltet fra en samling af empiriske observationer til en mere streng og systematisk videnskab.
Sidste artikelHar Mars vulkaner aktive nu?
Næste artikelHvad er afstand fra solen i km?
 Varme artikler
Varme artikler
-
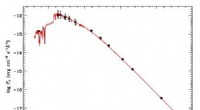 Ny lithium-rig Cepheid opdaget i MælkevejenSpektral energifordeling af V363 Cas. Kredit:Catanzaro et al., 2020. Italienske astronomer har rapporteret opdagelsen af en ny lithium-rig galaktisk Cepheid-stjerne, identificeret ved højopløsni
Ny lithium-rig Cepheid opdaget i MælkevejenSpektral energifordeling af V363 Cas. Kredit:Catanzaro et al., 2020. Italienske astronomer har rapporteret opdagelsen af en ny lithium-rig galaktisk Cepheid-stjerne, identificeret ved højopløsni -
 NASA opsender satellit for at udforske, hvor luft møder rummetI denne 1. okt. 2019-billede gjort tilgængeligt af NASA, et Northrop Grumman L-1011 Stargazer fly letter fra Vandenberg Air Force Base i Californien. Selskabets Pegasus XL raket, indeholdende NASAs Io
NASA opsender satellit for at udforske, hvor luft møder rummetI denne 1. okt. 2019-billede gjort tilgængeligt af NASA, et Northrop Grumman L-1011 Stargazer fly letter fra Vandenberg Air Force Base i Californien. Selskabets Pegasus XL raket, indeholdende NASAs Io -
 Et køligt kamera - LSSTs kryostatsamling afsluttetKryostaten leverer den optiske bænk (et siliciumcarbidgitter), der holder det store brændplan med en diameter på 65 cm - sammensat af 189 CCD -billedsensorer - fladt inden for kun en tiendedel af et m
Et køligt kamera - LSSTs kryostatsamling afsluttetKryostaten leverer den optiske bænk (et siliciumcarbidgitter), der holder det store brændplan med en diameter på 65 cm - sammensat af 189 CCD -billedsensorer - fladt inden for kun en tiendedel af et m -
 julekalkun, frugtkage, der stormer mod rumstationenFørste trins booster fra en Falcon 9 raket oplever et kontrolproblem under sin nedstigning, lander i Atlanterhavet lige øst for opsendelsesstedet i stedet for en landingszone ved Cape Canaveral Air Fo
julekalkun, frugtkage, der stormer mod rumstationenFørste trins booster fra en Falcon 9 raket oplever et kontrolproblem under sin nedstigning, lander i Atlanterhavet lige øst for opsendelsesstedet i stedet for en landingszone ved Cape Canaveral Air Fo
- Hvorfor er det vigtigt for forskere at registrere deres observationer?
- Hvilken erklæring ville sandsynligvis komme fra en sociolog ved hjælp af den strukturelle funktion…
- Er hamp nøglen til en bæredygtig fremtid?
- Jeg vil have sne til jul:Studerende kræver klimaindsats
- Hvad er cellestørrelsen under mitose?
- Hvorfor er der så mange jordskred i Puget Sound -området?


