Kinesins ignorerer svage kræfter, da de bærer tunge byrder
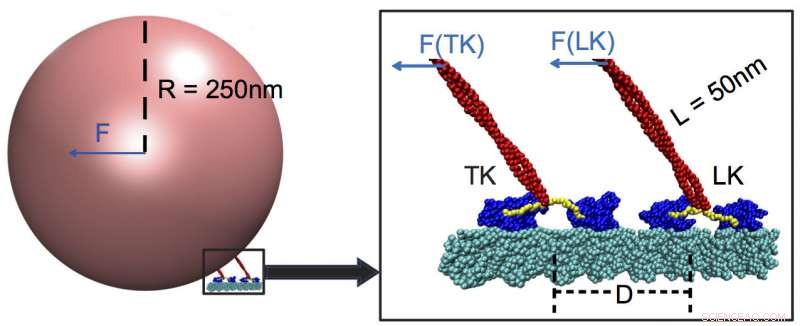
To bærende kinesiner, når de transporterer last langs en mikrotubuli (cyan). Forskere fra Rice University og University of Houston fastslog, at motorproteiner reagerer bedst på stærke kræfter og næppe overhovedet på svage, selv dem, der anvendes af motorer, der er fastgjort til samme last. I dette eksempel, den ledende kinesin (LK) bærer det meste af belastningen, med motorhoveder (blå) aktiveret af en nakkelinker (gul), der forbindes til stilken (rød) og fornemmer tilstedeværelsen af lasten. Kredit:Center for Teoretisk Biologisk Fysik/Rice University
Hvis du er motorproteinet foran, være forberedt på at gøre det tunge træk.
Det er en konklusion fra en Rice University-ledet undersøgelse af de mekanismer, der driver kinesiner, motoriske proteiner, der transporterer last inde i celler. Undersøgelsen viser, at det kræver en masse modkraft at bremse en bestemt kinesin. Proteinet får heller ikke meget hjælp fra kolleger, der opdrager bagdelen.
Den teoretiske undersøgelse detaljeret i Proceedings of the National Academy of Sciences og ledet af Rice postdoc-forsker Qian Wang var et samarbejde mellem laboratorierne for tre professorer ved Rice og en ved University of Houston, alle arbejder under paraplyen af Rice's Center for Teoretisk Biologisk Fysik (CTBP).
De håber at tilføje viden om de lidt forståede arbejdsheste inde i celler, der er kritiske for celledeling såvel som godstransport. Defekte eller mangelfulde kinesiner er impliceret i Charcot-Marie-Tooths sygdom og nogle nyresygdomme.
Gennem computersimuleringer, forskerne giver de første detaljer på molekylært niveau om, hvordan kinesiner reagerer på eksterne kræfter, mens de bekræfter tidligere eksperimenter af medforfatter Michael Diehl, der viste, at hold af kinesiner kun fungerer bedst, når de er tæt på hinanden og kan trække i samme retning.
"Vi forstår mere eller mindre enkeltmotorer, " sagde Rice biofysiker og medforfatter Anatoly Kolomeisky, hvis tidligere forskning viste, at motorproteiner er følsomme over for andres tilstedeværelse. "I naturen, de arbejder i teams, men fordi motorerne reagerer relativt svagt på en betydelig række kræfter, vi hævder, at dette er hovedårsagen til, at kinesins ikke altid samarbejder med hinanden."
Kinesiner omdanner energi fra det kemiske ATP, eller adenosintrifosfat, til mekanisk handling. De binder sig til store laster som mitokondrier eller kromosomer og trækker dem langs cytoskeletfilamenter til det fjerne af en celle. Hver kinesin indeholder to "hoved" underenheder, og hver underenhed indeholder to bindingssteder - et til at gribe og gå langs mikrotubuli og det andet til at binde ATP.
Modellerne viste kinesiner, en familie af motormolekyler opdaget i 1985, er "svagt modtagelige" for små eller mellemstore ydre kræfter og trækker deres last gennem næsten meget stærk modstand. Blandt de svage kræfter er dem, der påføres af slæbende kinesiner knyttet til den samme last.
Det viser sig, at disse holdkammerater knap registrerer sig til chefkinesin, hvis de er mere end 48 nanometer væk. Når det er tilfældet, blykinesinen bærer mere end 90 procent af belastningen.
Ris-simuleringerne afslørede, at lederen er mere opmærksom på selve lastens træk, som udløser en "switch" i nakkelinkeren, del af stilken, der trækker lasten som en snor på en ballon. Linkeren kobler lasten til hovedmotorernes ATP-bindingssteder, som igen styrer hastigheden. En slæbende kinesin, der er for langt væk, mærker ikke kraften og kan derfor ikke bidrage med sin muskel.
"Når motoren bevæger sig, nakkelinkeren bliver belastet, " sagde Rice biofysiker José Onuchic, en medforfatter og meddirektør for CTBP. "Hvis den linker ikke er anstrengt, motoren mister hastighed, fordi den ikke kan træffe en beslutning på egen hånd. Denne konkurrence mellem belastning og binding til mikrotubuli er nødvendig for at garantere processivitet af denne motor."
Basissimuleringen vil give forskere mulighed for at teste flere kinesiner, der flytter last fra kernen til cellens ydre grænser og, til sidst, dyniner, større og mere komplekse proteiner, der flytter last mod midten.
"Du skal gøre dette første skridt rigtig godt og meget detaljeret for at få selvtillid, før du tackler et udyr som dynein, " sagde Diehl. "Disse fyre har arbejdet meget hårdt i årevis gennem flere undersøgelser og trukket sammen, samlet, en måde at opregne og analysere overgangene mellem nøgletrin i denne mekaniske proces.
"Nu, at være i stand til at tage den tilgang til en motor som dynein har mulighed for at forklare en masse vigtige, fundamentale mysterier om, hvordan et protein, der kompleks fungerer, " han sagde.
"Det er den slags undersøgelse, som en enkelt hovedefterforsker ville have svært ved at lave, " sagde Onuchic. "For problemer, der er så komplicerede, det er godt at have denne kombination af talent."
Sidste artikelSilkeabebørn får et løft af opmærksomme fædre
Næste artikelTropisk mangfoldighed slår rod i forholdet mellem svampe og frø
 Varme artikler
Varme artikler
-
 Hvorfor kan vi ikke huske at være babyer?Kan du huske din første fødselsdagsfest? De fleste mennesker gør det ikke. Hvorfor det? Ryan McVay/Photodisc/Thinkstock Du kigger på den muntre skare, der var samlet omkring dig, tag et nysgerrigt ki
Hvorfor kan vi ikke huske at være babyer?Kan du huske din første fødselsdagsfest? De fleste mennesker gør det ikke. Hvorfor det? Ryan McVay/Photodisc/Thinkstock Du kigger på den muntre skare, der var samlet omkring dig, tag et nysgerrigt ki -
 Fisk har komplekse personligheder, viser forskningEt mock-up billede, der viser en Trinidadian guppy (den lille fisk), en blå acara cichlide og en model af en hejre. Kredit:University of Exeter Små fisk kaldet Trinidadian guppy har individuelle p
Fisk har komplekse personligheder, viser forskningEt mock-up billede, der viser en Trinidadian guppy (den lille fisk), en blå acara cichlide og en model af en hejre. Kredit:University of Exeter Små fisk kaldet Trinidadian guppy har individuelle p -
 Hvordan køn og stereotyper kan forme vores forhold til hundeEn mand og hans hund. Kredit:Pierre Malou, Forfatter angivet Forholdet mellem mennesker og deres hunde kan være et varigt og kærligt bånd, hvis matchen er rigtig. Men når man anskaffer sig en hund
Hvordan køn og stereotyper kan forme vores forhold til hundeEn mand og hans hund. Kredit:Pierre Malou, Forfatter angivet Forholdet mellem mennesker og deres hunde kan være et varigt og kærligt bånd, hvis matchen er rigtig. Men når man anskaffer sig en hund -
 Hvilken del af nefronen er ansvarlig for reabsorptionen af vand?Menneske nyrer indeholder mere end en million nefroner eller individuelle filtreringsenheder. Hver nefron består af nyretuber og blodkar, der passerer stoffer frem og tilbage for at filtrere affald og
Hvilken del af nefronen er ansvarlig for reabsorptionen af vand?Menneske nyrer indeholder mere end en million nefroner eller individuelle filtreringsenheder. Hver nefron består af nyretuber og blodkar, der passerer stoffer frem og tilbage for at filtrere affald og
- Undersøgelse finder stigning i uligheder mellem arbejdspladser i USA, højindkomstlande
- Sådan beregnes en elektromagnets kraft
- Eksempler på sekundære forurenende stoffer
- Hvordan beskytter havskildpadder sig selv?
- Nye spor hjælper med at forklare, hvorfor PFAS -kemikalier modstår afhjælpning
- Forbehandling af bandager kan forbedre nanopartiklers antibakterielle egenskaber


