Cryo-EM-billeddannelse antyder, hvordan den dobbelte helix adskilles under replikation
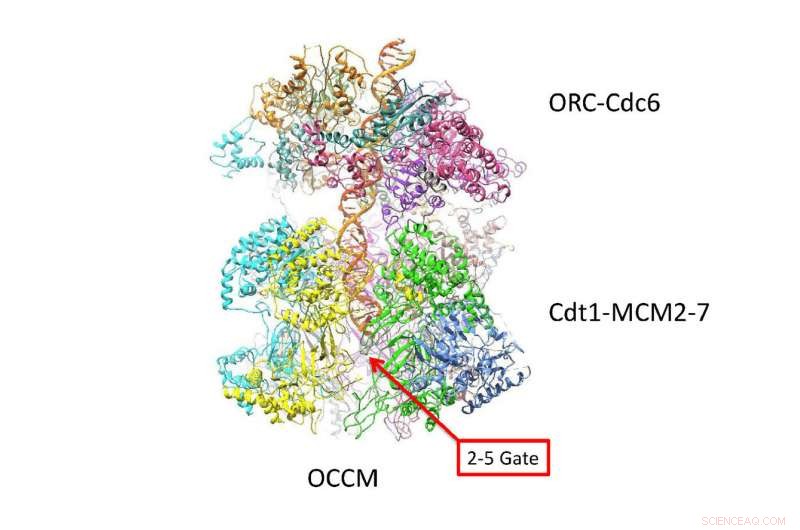
DNA følger en zig-zag-sti inde i en kanal skabt af to 6-sidede ringe. Dette nye atomniveau lavet med cryo-EM teknologi, antyder, hvordan DNA interagerer med de to ringe, lige før det adskilles i 'ledende' og 'efterliggende' strenge. Alt liv afhænger af absolut præcis koreogrpahy, når en celle skal replikere sit DNA for at danne to celler. Kredit:Van Andel Research Institute
Livet ville være umuligt, hvis DNA'et i delende celler blev replikeret med noget mindre end næsten perfekt præcision. Hver gang en celle med kerne forpligter sig til at blive til to celler, hvert "bogstav" i dets genom skal replikeres én gang og kun én gang. Hos mennesker, opgaven forvirrer fantasien. Hvis afviklet, den dobbelte helix, der er proppet ind i hver af vores celler, vil måle 6 fod i længden. Alene i vores knoglemarv, en halv milliard nye celler fødes hvert minut. Disse celler alene indeholder nok DNA til at vikles rundt om jordens ækvator 25 gange. Inden for skræmmende tolerancer, hver ny celle skal have et genom, der er identisk med det i den celle, der fødte det. Kræft og andre sygdomme kan opstå, når processen går skævt.
At finde ud af, hvordan nøjagtig replikation fungerer på niveauet for individuelle molekyler og atomer, er en af de store bedrifter i moderne videnskab. Efterforskernes rejse er endnu ikke færdig, imidlertid. En stor uløst del af gåden er at forstå, hvordan hele processen med at kopiere genomet begynder. I ny forskning, indsigt i, hvordan de to bevoksninger af den dobbelte helix adskilles i de tidligste stadier af replikation, er ved at blive klart.
Et mangeårigt samarbejde mellem forskere i London, Grand Rapids, Michigan og Cold Spring Harbor Laboratory (CSHL) i New York rapporterer strukturen på atomniveau af twin-helicase-enzymer, der er fyldt hoved til hoved, med DNA-dobbelthelixen synlig i den cirkulære kanal, der løber gennem begge helikaser. Konfigurationen, en del af det præ-replikative kompleks (præ-RC), er aldrig blevet afbildet med succes i denne konfiguration før.
Bedriften blev muliggjort af en ny cyro-elektronmikroskopi (cryo-EM) facilitet på Van Andel Research Institute, hjem for en af de ledende efterforskere, Dr. Huilin Li. Dr. Li har samarbejdet med Dr. Bruce Stillman fra CSHL og Dr. Christian Speck, Professor i genombiokemi og molekylærbiologi ved Imperial College i London i over et dusin år. I 1992, Stillman og kolleger opdagede proteinkomplekset kaldet oprindelsesreplikationskomplekset (ORC), som samler proteinkomplekser på mange steder kaldet "startsteder" langs den dobbelte helix, hvor replikationen starter. Dr. Specks arbejde viste, at ORC kombinerer med andre proteiner - Cdc6, Cdt1 og hexameren af Mcm2-7 - for at begynde processen med at duplikere DNA.
En stor del tidligere indsats har afsløret, hvordan ORC samler og finder startsteder. Der er mange sådanne websteder, organiseret efter domæner, i det komplekse menneskelige genom; mange færre i simplere livsformer som bagegær. Den nye forskning drejer sig om, hvad der sker efter den første genkendelse af startstederne, og hvordan DNA-spiralen kan afvikles.
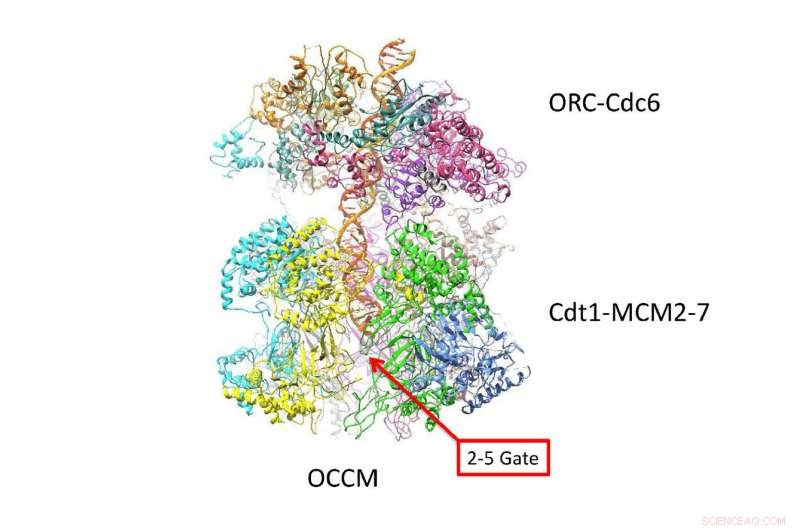
DNA-dobbelthelixen følger en zig-zag-sti inde i en kanal skabt af to 6-sidede ringe. Denne nye visning på atomniveau lavet med cryo-EM-teknologi, antyder, hvordan DNA interagerer med de to ringe, lige før det adskilles i 'ledende' og 'efterliggende' strenge. Alt liv afhænger af absolut præcis koreografi, når en celle skal replikere sit DNA for at danne to celler. Kredit:Van Andel Research Institute
Som levende vist i de nye cryo-EM "billeder, "de to sekssidede Mcm2-7 helicase-enzymer, der omgiver den dobbelte helix, ligner symmetriske insekter eller, måske, dobbelt rumfartøj forankret hoved til hoved. Spørgsmålet, som den nye struktur besvarer, er, hvordan den dobbelte helix er placeret i den kanal, de danner, og hvordan DNA interagerer med den omgivende struktur. Baseret på den nye viden, indsigt i, hvordan de to DNA-strenge adskilles, længe et mysterium, begynder at blive afsløret.
"De nye billeder viser, at når de er indlæst i den dobbelte hexamer-eller DH, som vi kalder head-to-head helikaserne - den dobbelte helix tager en zig-zaggende vej gennem den centrale kanal, som er lidt bøjet, " forklarer forfatterne. "De to tøndeformede hexamere er placeret på en sådan måde, at de er klar til at vride den dobbelte helix, når de aktiveres."
En konsekvens er særlig vigtig:vridningen i strukturen af komplekset dannet af de dobbelte ringe skaber en vridningsbelastning:de belastes med en iboende spænding, der gør dem til noget som en spiralfjeder. Detaljer i strukturen, der ikke tidligere er set, afslører, hvordan forskellige proteinunderenheder af tvillingehexamererne låser sig på den dobbelte helix, via bittesmå løkkelignende strukturer.
Scenariet opstillet af Li, Speck, Stillman og deres kolleger er, at de to hexamerer belastes i spænding, forårsager en af de to strenge af DNA'et, der passerer gennem dem, til bogstaveligt talt at samle sig mod en lukket "dør" på den ene side af ringen, og den anden streng mod en anden lukket "dør" på den modsatte side. Holdet foreslår, at en af de to døre åbnes, når replikationsprocessen aktiveres (ved hjælp af proteinkinaser og andre hjælpemolekyler).
Gennem den åbne dør i spiralen - men kun på den ene side - tvinges den ene streng af den dobbelte helix ud, eller "ekstruderet". Holdet foreslår, at det bliver det, der kaldes den "lagging streng" i DNA-replikationsprocessen. Den anden streng, forbliver i midten af den spiralformede kanal, bliver den "ledende streng" i replikation. Molekylærmotorer indlæst på de to hexamere giver energi til deres adskillelse. Den ene aktiverede helicase passerer den anden, efterhånden som replikering af hver streng skrider frem i modsatte retninger, som udledt af biologer for årtier siden.
De nyeste strukturer blev muliggjort af fremskridt i teknikken kaldet kryo-elektronmikroskopi, hvor en elektronstråle føres gennem frossen, enkelte protein-DNA-partikler for at opnå et 3-dimensionelt billede på næsten atomniveau. De vigtigste udviklere af metoden, som nu er meget brugt, modtog Nobelprisen i kemi 2017.
 Varme artikler
Varme artikler
-
 Undersøgelse identificerer flaskehalse i tidlig havgræsvækstHavgræssens frugter Posidonia australis . Kredit:J. Statton/UWA. strandenge, vigtige planteskoler og foderpladser for mange slags havliv, går tabt verden over på grund af næringsstofforurening,
Undersøgelse identificerer flaskehalse i tidlig havgræsvækstHavgræssens frugter Posidonia australis . Kredit:J. Statton/UWA. strandenge, vigtige planteskoler og foderpladser for mange slags havliv, går tabt verden over på grund af næringsstofforurening, -
 Hvordan høje træer flytter sukkerMichael Knoblauch (højre) og søn, Jan, er medforfattere til en undersøgelse, der har besvaret en debat i flere årtier om, hvordan sukker transporteres i træer. Kredit:Noel Michele Holbrook Forsker
Hvordan høje træer flytter sukkerMichael Knoblauch (højre) og søn, Jan, er medforfattere til en undersøgelse, der har besvaret en debat i flere årtier om, hvordan sukker transporteres i træer. Kredit:Noel Michele Holbrook Forsker -
 Er behovet for privatliv evolutionært?Lad ikke det tydeligt menneskelige hoteltegn narre dig. Mennesker er bare et af mange dyr, der kræver mindst en vis grad af privatliv. John Foxx/Stockbyte/Thinkstock Det er mærkeligt at tænke på, at
Er behovet for privatliv evolutionært?Lad ikke det tydeligt menneskelige hoteltegn narre dig. Mennesker er bare et af mange dyr, der kræver mindst en vis grad af privatliv. John Foxx/Stockbyte/Thinkstock Det er mærkeligt at tænke på, at -
 Det mægtige Banyan -træ kan gå og leve i århundrederBanyan træer sender rødder ned fra deres grene i jorden, tillader dem at sprede sig lateralt over lange afstande. florentina georgescu photography/Getty Images I hovedstaden i den indiske delstat Wes
Det mægtige Banyan -træ kan gå og leve i århundrederBanyan træer sender rødder ned fra deres grene i jorden, tillader dem at sprede sig lateralt over lange afstande. florentina georgescu photography/Getty Images I hovedstaden i den indiske delstat Wes
- Liste over de 3 trin, der finder sted under interfase
- Stjernepletter:Opløfter variabiliteten af sollignende stjerner
- Nanopartiklernes vugge
- Ved at lytte til optisk støj, forskere opdager en ny måde at spore skjulte objekter på
- To-stråle super-opløsning litografi brugt til at skabe 3D fotoniske gyroide nanostrukturer
- Pressefrihedsgruppen gemmer censurerede artikler i Minecraft -biblioteket


