Fremskridt i kryo-elektronmikroskopi bringer liv på atomniveau til et klarere syn
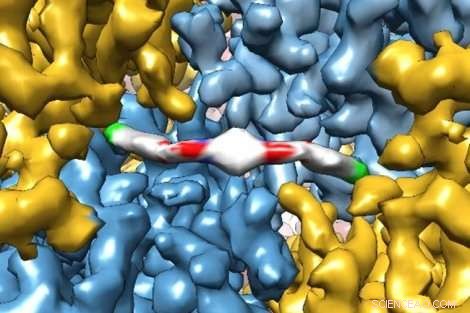
Et banebrydende kryo-elektronmikroskopibillede viser ekstremt detaljeret, hvordan et nyt terapeutisk molekyle interagerer med et protein, giver forskere indsigt i, hvordan det fungerer i menneskekroppen. Molekylet, ISRIB, blev vist i en nylig undersøgelse af UCSFs Peter Walter, PhD, og Susanna Rosi, PhD, at genoprette hukommelsessvigt hos patienter med traumatisk hjerneskade. Kredit:Adam Frost Lab
Forskere fra UC San Francisco fangede for nylig udsøgte billeder af et protein fanget i færd med at binde sig til et nyt terapeutisk lægemiddel med tilstrækkelig opløsning til at modellere, hvordan de individuelle atomer i proteinet og stoffet stiller sig op.
Indtil for nylig, en sådan bedrift ville have været anset for umulig, men i de sidste fem år, sådanne gennembrud er blevet næsten almindelige her, del af en opløsningsrevolution, der ledes af UCSF-forskere.
Takket være deres seneste fremskridt inden for kryo-elektronmikroskopi (cryo-EM) – en teknik, hvis opfindere blev hædret med 2017 Nobelprisen i kemi – har disse forskere muliggjort hurtige fremskridt i søgningen efter mere præcise og kraftfulde terapier til en bred vifte af menneskelige sygdomme.
Proteiner er små molekylære maskiner, der driver alt, hvad vores celler gør - og de er også de primære mål for farmaceutiske lægemidler. At opdage, hvordan nye proteiner virker, kan føre til livreddende behandlinger mod kræft eller nye smertestillende midler med mindre risiko for afhængighed.
Men for virkelig at forstå, hvordan proteiner fungerer, forskere skal kunne visualisere dem på atomare skala. Tidligere krævede dette omhyggeligt voksende krystaller af et protein-en proces, der kunne tage år at få det rigtigt-for derefter at skyde røntgenstråler gennem krystallerne for at beregne proteinets atomsammensætning. Desværre, mange af de mest interessante proteiner og komplekser kan ikke krystalliseres.
Cryo-EM har eksisteret siden 1970'erne, men siden 2013 er de tekniske fremskridt delvist banebrydende af UCSF's David Agard, PhD, og Yifan Cheng, PhD, har dramatisk forbedret cryo-EMs evne til at løse både de mindste og de mest komplekse proteiner i fantastiske detaljer, transformerer elektronmikroskopet fra en gammeldags arbejdshest bagfra til den nyeste videnskabelige superstjerne næsten fra den ene dag til den anden.
Denne cryo-EM-renæssance blev ansporet af Agard og Chengs bestræbelser på at udvikle kamerahardware og software, der er i stand til at detektere enkeltelektroner-et mål, der længe havde været anset for upraktisk af feltet, men som duoen opnåede ved at samle videnskabsmænd og ingeniører ved UCSF, Lawrence Berkeley National Laboratory, og Gatan, en Pleasanton, Californien, firma, der laver EM -kameraer.
"For ikke længe siden troede hele feltet at tælle enkelte elektroner aldrig ville fungere, "Cheng husker. "Men på UCSF, kulturen fostrer os til at gøre ting, som alle andre tror er umulige."
På trods af mange af deres jævnaldrende skepsis, Agard og Cheng - som begge er professorer i biokemi og biofysik ved UCSF og Howard Hughes Medical Institute -efterforskere - erkendte, at indfangning af enkeltelektroner var afgørende for elektronmikroskopers evne til at løse vigtige biologiske proteiner i tilstrækkelig detaljer til, at forskere kunne forstå deres funktion.
En illustration viser de kryo-EM-billeder, der var mulige før 2013, yderst til venstre og meget højere opløsning af kryo-EM-billeder, der er tilgængelige i dag, til højre. Disse højopløselige billeder gør det muligt for forskere at konstruere molekylære modeller af svære at studere proteiner (yderst til højre). Kredit:Martin Högbom/Det Kongelige Svenske Videnskabsakademi
"Det er ikke kun et spørgsmål om at se proteiner lidt mere klart, "Forklarede Agard." Der er et præcist punkt, hvor man går fra at se temmelig ubrugelige klatter til direkte at kunne fortolke et molekyls struktur. Elektrontællekameraer gav virkelig et kvantespring i vores evne til at forstå et proteins underliggende kemi – både hvordan det fungerer, og hvordan du kunne designe lægemidler, der binder til det."
Siden deres første storfilm i 2013 demonstrerede, at de nye kameraer og software kunne løse proteiner i næsten atomær opløsning, Teknologien er blevet udbredt i feltet. Det har også muliggjort store fremskridt inden for Cheng og Agards egen forskning, fra at forstå proteiner nøglen til følelsen af smerte, som kunne blive målrettet af en ny generation af lægemidler, til opdagelser om, hvordan proteiner bevarer deres rette form, som har store konsekvenser for kræft og sygdomme som Alzheimers sygdom, der er kendetegnet ved uformede proteiner.
En anden førende cryo-EM-forsker ved UCSF, Adam Frost, MD, PhD, som kom til universitetet som adjunkt i 2014 for at drage fordel af kraften i denne nye teknologi, har ført an i bestræbelserne på at bruge cryo-EM til at bestemme, hvordan nye klasser af lægemidler binder til deres målproteiner på atomniveau.
"Cryo-EM is now allowing us to study proteins at a level of detail that would never have been possible just a few years ago, " Frost said.
Frost and Cheng have also been using cryo-EM to understand how signaling proteins on the surfaces of cells – key targets for pharmaceuticals from pain killers to cancer therapies – are influenced by the cell membranes in which they float and how proteins can bend and shape the membranes. Især the ability to examine the structure of proteins in their native membranes – which had also been considered impossible by the field – was achieved for the first time in 2016 by Cheng.
The recent work with cryo-EM has been so successful that many researchers at UCSF have begun clamoring for a share of the limited microscopy time available on shared scopes. Heldigvis, with the acquisition earlier this year of new fully automated cryo-electron microscopes, including a $5 million state-of-the-art Titan Krios system funded by the Howard Hughes Medical Institute, a $6 million Titan Krios funded by an anonymous donor for the UCSF Institute of Neurodegenerative Disease – part of the UCSF Weill Institute for Neurosciences – and a $3 million Arctica system funded by the National Institutes of Health and UCSF, more and more researchers across the University and the Bay Area will be able to take their research to the next level.
Agard sees the cryo-EM revolution as closely synergistic to other burgeoning efforts on campus to completely map out the biology of disease, such as the work of Nevan Krogan, PhD, the director of UCSF's Quantitative Biosciences Institute, who is mapping the common networks of genes and proteins that drive diseases ranging from cancer to HIV to schizophrenia; and the work of Brian Shoichet, PhD, whose lab in UCSF's School of Pharmacy uses protein structures to computationally design custom drugs that fit like lock and key into target proteins.
"There is a remarkably integrated pipeline being developed at UCSF, with new technologies and approaches feeding off one another to advance our knowledge of the biology of disease at every level, " Agard said. "This is beginning to have a huge impact all around campus, but now we need to scale it up to lower barriers and speed the transition from images to therapies."
 Varme artikler
Varme artikler
-
 Krybskytteri på elefanter i Afrika falder, men elfenben beslaglægges:undersøgelsehele kontinentet, Botswana har flest elefanter, mens befolkningerne i Kenya, Namibia, Rwanda, Sydafrika og Uganda holder fast eller stiger Elefanters krybskytteri i Afrika faldt for femte år i træ
Krybskytteri på elefanter i Afrika falder, men elfenben beslaglægges:undersøgelsehele kontinentet, Botswana har flest elefanter, mens befolkningerne i Kenya, Namibia, Rwanda, Sydafrika og Uganda holder fast eller stiger Elefanters krybskytteri i Afrika faldt for femte år i træ -
 Jomfruhun-edderkopper fundet villige til at give sig selv op til at blive spist levende af edderkopp…Samfundets rede edderkop, Stegodyphus dumicola. Kredit:Wikipedia/CC BY-SA 2.0 (Phys.org)—Et team af forskere med Ernst Moritz Arndt Universitet i Tyskland og Aarhus Universitet i Danmark har funde
Jomfruhun-edderkopper fundet villige til at give sig selv op til at blive spist levende af edderkopp…Samfundets rede edderkop, Stegodyphus dumicola. Kredit:Wikipedia/CC BY-SA 2.0 (Phys.org)—Et team af forskere med Ernst Moritz Arndt Universitet i Tyskland og Aarhus Universitet i Danmark har funde -
 Hvor er grænsen mellem fandom og besættelse?Deltagere klædt i forskellige kostumer deltager i Wizard World Chicago Comic Con 2016. Bilgin S. Sasmaz/Anadolu Agency/Getty Images Da Arthur Conan Doyle skabte den fiktive detektiv Sherlock Holmes i
Hvor er grænsen mellem fandom og besættelse?Deltagere klædt i forskellige kostumer deltager i Wizard World Chicago Comic Con 2016. Bilgin S. Sasmaz/Anadolu Agency/Getty Images Da Arthur Conan Doyle skabte den fiktive detektiv Sherlock Holmes i -
 5 måder at maksimere lykke påLigesom du kan træne dine muskler, du kan træne din hjerne til lykke. © iStockphoto.com/aldra Siden 1937 har en pulje af 268 mænd, der er uddannet fra Harvard University, er blevet analyseret, unders
5 måder at maksimere lykke påLigesom du kan træne dine muskler, du kan træne din hjerne til lykke. © iStockphoto.com/aldra Siden 1937 har en pulje af 268 mænd, der er uddannet fra Harvard University, er blevet analyseret, unders
- Migrerende snelinje spiller en overordnet rolle i at sætte tempoet for, at issmeltningen på Grønl…
- UAE sender rover til Månen i 2022
- Ny algoritme optimerer kvantecomputing-problemløsning
- Samtidige røntgen- og infrarøde observationer af det galaktiske center
- Løst:Mysteriet med korncirklerne i nanoskala
- Opstår tornadoer kun i Nordamerika?


