Forkølelsesvirus afslører en af deres styrker
Den almindelige forkølelsessæson er tilbage, som får folk til at undre sig over, hvorfor vi fanger den samme virus, år efter år. Hvorfor udvikler vi aldrig immunitet mod forkølelse? Professor Pierre Talbot ved INRS har kendt til den utrolige variation af coronavirus i nogen tid. De er ansvarlige for forkølelse såvel som mange andre infektioner, herunder neurologiske sygdomme. Sammen med sin forskningsmedarbejder Marc Desforges, Professor Talbot arbejdede på en undersøgelse for nylig offentliggjort i Naturkommunikation om de måder, hvorpå coronavirus tilpasser sig og udvikler sig, bliver stadig mere effektive til at inficere værter uden at blive besejret af immunsystemet.
De små, spidse kugler, Coronavirussen overvåges nøje af offentlige sundhedsmyndigheder, da de er i stand til at blive overført mellem arter, og nogle har en høj potentiel dødelighed. Både SARS og MERS er forårsaget af coronavirus. Deres evne til at tilpasse sig nye miljøer synes til dels at skyldes spidserne på overfladen af virussen - mere specifikt, en lille, strategisk del af proteinerne, der danner disse pigge.
Piggene er opbygget af S-proteiner (S for spike). En specifik del af spidsen ser ud til at tillade virussen at binde sig til værtsceller. Piggens RBD (receptorbindingsdomæne), som initierer interaktionen mellem celle og virus, er afgørende for infektion. Men RBD'er er målrettet af antistoffer, der neutraliserer virussen og tillader immunsystemet at skylle det ud af værtens system.
Coronaviruses står derfor over for et evolutionært problem. De kan ikke inficere celler uden en RBD, som skal blotlægges, så det kan låse fast i celler. Men RBD skal maskeres for at undgå at blive målrettet af antistoffer.
Som svar, coronavirus har udviklet en mekanisme, der hjælper den med at overleve, og trives. RBD består af tre dele, der varierer meget mellem stammer. Takket være denne variation, antistoffer er ude af stand til at opdage nye stammer, hvorimod RBD'er bevarer - og endda forbedrer - deres affinitet til målcellen. Plus, RBD'er veksler mellem synlige og maskerede tilstande.
For at opnå denne indsigt, en gruppe forskere inklusive professor Talbot studerede alphacoronavirus HCoV-229E og, mere specifikt, interaktionen mellem dets RBD og aminopeptidase N (APN) - værtscelleproteinet, som RBD griber om. Holdet krystalliserede multiproteinkomplekset og analyserede derefter strukturerne af begge proteiner.
Ved at observere RBD's struktur tæt på, holdet var i stand til at identificere de tre lange løkker, der låses på APN. Som analyser af disse vira gennem de sidste halvtreds år har vist, disse løkker er stort set det eneste, der varierer fra den ene stamme til den næste.
Eksperimenterne viser, at ændringerne observeret i løkkerne modulerer en RBD's affinitet med APN. De varianter, der har den største affinitet, vil sandsynligvis også være bedre til at inficere værtsceller, som hjælper dem med at sprede sig. Seks forskellige klasser af HCoV-229E er dukket op gennem årene, hver med en større RBD-APN-affinitet end den sidste.
Denne opdagelse bidrager til vores forståelse af udviklingen af coronavirus og kan føre til lignende analyser af andre coronavirus. Selvom der er mange elementer tilbage at forklare, RBD ser ud til at være en vigtig egenskab, der skal overvåges, når vi følger den adaptive udvikling af disse vira og vurderer deres evne til at inficere.
 Varme artikler
Varme artikler
-
 Majsgenetik giver indsigt i de afgrøder, der er historiske spredt over hele AmerikaKredit:Research Square Iowa State University-forskere har taget en rejse gennem fortiden ved at studere de genetiske ændringer i majs forårsaget af domesticering. En undersøgelse offentliggjort i
Majsgenetik giver indsigt i de afgrøder, der er historiske spredt over hele AmerikaKredit:Research Square Iowa State University-forskere har taget en rejse gennem fortiden ved at studere de genetiske ændringer i majs forårsaget af domesticering. En undersøgelse offentliggjort i -
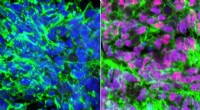 Forskere laver celler, der aktiverer følesansenHumane embryonale stamcelle-afledte neuroner (grønne), der viser kerner i blåt. Til venstre:tilsat retinsyre. Til højre:tilsat retinsyre og BMP4, skabe proprioceptive sensoriske interneuroner (lyserød
Forskere laver celler, der aktiverer følesansenHumane embryonale stamcelle-afledte neuroner (grønne), der viser kerner i blåt. Til venstre:tilsat retinsyre. Til højre:tilsat retinsyre og BMP4, skabe proprioceptive sensoriske interneuroner (lyserød -
 Ny procedure for hurtigere opdagelse af miljøpåvirkninger fra laksefarmeDisse fisk dyrkes i store bure ud for kysten i cirka to år. Kredit:Stoeck For at imødekomme efterspørgslen efter laks, mange laksefarme har udviklet sig langs Skandinaviens og Skotlands kyster. Di
Ny procedure for hurtigere opdagelse af miljøpåvirkninger fra laksefarmeDisse fisk dyrkes i store bure ud for kysten i cirka to år. Kredit:Stoeck For at imødekomme efterspørgslen efter laks, mange laksefarme har udviklet sig langs Skandinaviens og Skotlands kyster. Di -
 Tornadoer-effekter på PeopleTornadoes udøver ødelæggelse, uanset hvor de rører ned. Udover at forårsage tab af liv, flytter tornadoer bygninger, plukker træer fra jorden og sender noget, der ikke er forankret til jorden, der fly
Tornadoer-effekter på PeopleTornadoes udøver ødelæggelse, uanset hvor de rører ned. Udover at forårsage tab af liv, flytter tornadoer bygninger, plukker træer fra jorden og sender noget, der ikke er forankret til jorden, der fly
- Ny teori sender temperaturer til nye lavpunkter
- Fejlprognose:Datavidenskab forudsiger, hvilke fejl der i sidste ende vil lykkes
- Forskere måler nærfeltsadfærd af halvlederplasmoniske mikropartikler
- Verdens aldrende store dæmninger udgør en ny risiko:FN
- Multi-tasking ler kan rydde op i jordforurening
- Største simuleringer nogensinde hjælper med at afdække galaksens historie


