Forsker diskuterer den biologiske krydstale mellem mikrober og værter
Stavroula Hatzios lytter med til dialoger mellem smitsomme bakterier og værtsceller. Uddannet i kemi ved MIT og Berkeley, hun kom til West Campus i januar 2017 som fakultetsmedlem af Microbial Sciences Institute og Institut for Molekylær, Mobil, og udviklingsbiologi. Hatzios blev interesseret i infektionssygdomme som kandidatstuderende og besluttede at fokusere på mikrobiologi som Harvard-postdoc. I dag anvender hendes laboratorium kemiske værktøjer til at studere, hvor farlige mikrober, inklusive den, der forårsager kolera, interagere med værten. Det, hun lærer, kunne pege på nye strategier til at bekæmpe infektion.
Hvad mener du med vært-mikrobe-interaktioner?
Der er mange kommunikationslag, der kan eksistere mellem mikrobielle og værtsceller i et inficeret dyr. Jeg omtaler det som en dialog. Mikrober kan bruge proteiner og små molekyler til at kommunikere med hinanden, da de danner store samfund, og tilsvarende, værtsceller kan udskille molekyler, der gør det muligt for dem at kommunikere med hinanden. Og nogle gange kan denne krydstale også lette kommunikationen mellem værtsceller og mikrobielle celler.
Hvilken slags dialoger hører du?
Vi studerer kolerabakterien, Vibrio kolerae. Lad os sige, at du er i Haiti efter jordskælvet i 2010, da der var brud på vandforsyningen, og du indtager vand, der har kolerabakterier i sig. Bakterierne kan ende med at kolonisere din tyndtarm, og når de først er der, de kan producere en række forskellige proteiner, der kan påvirke, hvordan værten reagerer på infektionen, og hvordan bakterierne overlever. Et af disse proteiner er koleratoksin, en af de vigtigste mediatorer af diarré, der udvikler sig hos inficerede værter. Det fører til massiv dehydrering, og tabet af væske kan dræbe ret hurtigt. Men bakterierne producerer også andre proteiner, der kan være vigtige for deres interaktion med værten, eller deres overlevelse.
For at forespørge på dialogen mellem vært og mikrober, vi anvendte en teknik kaldet aktivitetsbaseret proteinprofilering. Denne tilgang bruger små molekyle prober, der kan binde til specifikke proteiner baseret på deres biokemiske aktivitet. Vi var i stand til at identificere en masse forskellige bakterie- og værtsudskilte proteiner med definerede biokemiske aktiviteter i dyremodeller af kolera og i human kolerisk afføring.
Hvor mange proteiner taler vi om?
I dette tilfælde, vi identificerede over 200. For mange af dem ved vi ikke, hvad de laver. Trin et er at identificere disse proteiner, der er aktive i infektionen. Trin to er at finde ud af, hvad de laver. Og trin tre er at bruge dem som værktøjer - enten til at hæmme udviklingen af sygdom ved at hæmme deres biokemiske aktivitet, eller bruge dem som diagnostiske markører, eller biomarkører, for sygdom.
Under min postdoc, vi identificerede disse fire bakterielle proteaser, som er enzymer, der kan hugge andre proteiner op. Disse produceres af kolerabakterien i tarmen – de blev konsekvent identificeret i hver eneste af vores analyser af inficerede kaniner. Vi var i stand til at forbinde dem med et værtsprotein, der udskilles af kanin-tarmceller og binder til kolerapatogenets celleoverflade. Vi fandt ud af, at disse fire patogen-udskilte enzymer hæmmer bindingen af dette protein til den bakterielle overflade.
Konstateringen af, at denne interaktion forekommer i et inficeret dyr - og at kolerapatogenet kan producere proteaser for at hæmme denne interaktion - er virkelig interessant. Vi mener, at denne interaktion kan strække sig til andre tarmmikrober, såvel. Flere andre etablerede grupper undersøger nu denne mulighed, og jeg er spændt på at se, hvad de opdager. Regulerer denne interaktion på en eller anden måde sammensætningen af mikrobielle samfund i tarmen? Er det regulering af, hvordan tarmpatogener interagerer med værten? Hjælper det med at fjerne infektionen, eller bruger bakterierne det til at holde sig til værtsceller på en eller anden måde?
Det er som at analysere krigsførelse.
Det er! En af de proteaser, som vi identificerede i dette arbejde med kolera, ser ud til kun at være aktiv i et inficeret dyr. Hvorfor det er interessant er, at du kan forestille dig måder at udnytte aktiviteten af det enzym til din egen fordel. En måde, vi håber at gøre det på, er ved at generere prober af trojanske heste-proteiner, der er konstrueret til at efterligne naturlige proteasesubstrater, men som fører skjult last. Ideen er, at du kan introducere disse sonder til stedet for en infektion, og de ville kun blive aktiveret, når en specifik patogen-udskilt protease er til stede og aktiv. Det ville muliggøre rumligt og tidsmæssigt kontrolleret frigivelse af, Lad os sige, detektionsmidler, eller bakteriedræbende midler.
Hvor er din forskning på vej hen?
Vi tror, at reaktive oxygenarter - eller småmolekylære oxidanter, der produceres under infektioner - kan hjælpe med at tjene som et kommunikationsmiddel mellem værtsceller og nabomikrober. Historisk set, disse oxidanter betragtes som cytotoksiske (toksiske for celler). Men i de sidste to årtier eller deromkring, der har været en masse smukt arbejde, der viser, at lave niveauer af disse oxidanter produceres af værtsceller, der medierer bredere aspekter af udvikling, som differentiering, sårheling, motilitet. Vi er interesserede i, hvordan de påvirker signalering i mikrobielle celler, eller i værtsceller, når de er genereret efter mikrobiel kontakt med værten.
Dette oxidative krydstale arbejde, som vi udfører, bruger Helicobacter pylori, et mavepatogen, der forårsager mavekræft. Jeg er spændt på forhåbentlig at samarbejde med vores nye kollega her, juni Liu. Hans laboratorium er også interesseret i Helicobacter, og de har lavet noget fascinerende arbejde med at se på flagellerne af den bakterie ved hjælp af en teknik kaldet kryo-elektrontomografi.
Sidste artikelVandmænd på menuen
Næste artikelNye værktøjer hjælper jagten på livsforlængende kemikalier
 Varme artikler
Varme artikler
-
 Rensning for at overleve under havbundenMikroorganismer, der lever dybt under havbunden, udskiller enzymer for at nedbryde organisk materiale, der aflejres i sedimenterne. Kredit:Ludwig Maximilian University of Munich Mikroorganismer, d
Rensning for at overleve under havbundenMikroorganismer, der lever dybt under havbunden, udskiller enzymer for at nedbryde organisk materiale, der aflejres i sedimenterne. Kredit:Ludwig Maximilian University of Munich Mikroorganismer, d -
 Sundhedsforskere visualiserer et liv i silicoUConn Health biofysiker Leslie Loew, direktør for Center for Celleanalyse og Modellering. Kredit:Lanny Nagler for UConn Health Programmering af et molekylærbiologisk eksperiment kan svare til at s
Sundhedsforskere visualiserer et liv i silicoUConn Health biofysiker Leslie Loew, direktør for Center for Celleanalyse og Modellering. Kredit:Lanny Nagler for UConn Health Programmering af et molekylærbiologisk eksperiment kan svare til at s -
 Den utrolige rejse for den første afrikanske skildpadde, der ankom til EuropaRekonstruktion af Algorachelus peregrinus i et kystmiljø i Laurasia for 95 millioner år siden. Kredit:José Antonio Peñas For omkring 95 millioner år siden, en flodskildpadde tilpasset havmiljøer o
Den utrolige rejse for den første afrikanske skildpadde, der ankom til EuropaRekonstruktion af Algorachelus peregrinus i et kystmiljø i Laurasia for 95 millioner år siden. Kredit:José Antonio Peñas For omkring 95 millioner år siden, en flodskildpadde tilpasset havmiljøer o -
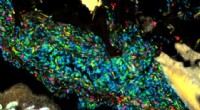 Blandet organisering af tarmbakterier afsløres af mikrobiom billeddannelsesteknologiBakterier i et model humant tarmmikrobiom etableret i en bakteriefri mus. Hver bakterieart lyses op med en forskellig farvet sonde, skabe et kort over samfundets rumlige organisation. Kredit:Jessica M
Blandet organisering af tarmbakterier afsløres af mikrobiom billeddannelsesteknologiBakterier i et model humant tarmmikrobiom etableret i en bakteriefri mus. Hver bakterieart lyses op med en forskellig farvet sonde, skabe et kort over samfundets rumlige organisation. Kredit:Jessica M
- Kina ser højteknologisk militær, siger, at USA underminerer global stabilitet
- Sådan Find Mean, Median, Mode og Range of a Set of Numbers
- Er mindre mere? Sådan ser forbrugerne på bæredygtighedskrav
- En ny måde at syntetisere antioxidante stoffer på
- Optimering af effektiviteten af kvantekredsløb
- Sådan finder du linjer af Symmetry


