Forskere udvikler en kraftfuld ny metode til mikrobiomanalyse
Forskere fra Icahn School of Medicine ved Sinai-bjerget, Sema4, og de samarbejdende institutioner New York University og University of Florida har i dag offentliggjort en rapport, der beskriver deres nye, mere præcis metode til at identificere individuelle mikrobielle arter og stammer i et samfund. Denne teknik har vigtige implikationer for mikrobiomanalyse, med potentielle langsigtede anvendelser til klinisk pleje. Avisen udkom i dag kl Natur bioteknologi .
Mikrobiomer er fællesskaber af bakterier, vira, og andre mikrober, der kan findes overalt fra overfladerne af tastaturer og mobiltelefoner til miljøer på og indeni os, såsom vores mund eller tarme. Afbrydelse af det naturlige mikrobiom har været impliceret i sundhedstilstande, herunder infektionssygdomme, kræftformer, og komplekse lidelser såsom Crohns sygdom, colitis ulcerosa, og diabetes, blandt mange andre. Succesfuld analyse af mikrobiomer afhænger af evnen til at zoome ind på disse samfund og identificere de individuelle arter og stammer, der lever i dem.
Til dato, de fleste teknikker til at identificere mikrobielle medlemmer af disse grupper giver utilstrækkelig opløsning. For eksempel, en art kan kun klassificeres som en del af dens bredere genetiske familie, snarere end entydigt identificeret i sig selv. Eksisterende metoder er heller ikke effektive til karakterisering af en vigtig klasse af genetiske materialer, der kan pendle mellem forskellige bakteriearter, kendt som mobile genetiske elementer.
I dette nye værk, videnskabsmænd brugte enkelt molekyle, Real-Time Sequencing-teknologi og nye beregningsværktøjer til at klassificere mikrober for første gang ved at analysere både deres genetiske kode og deres methyleringsmønstre, en anden DNA-kode, der regulerer genaktivitet. Denne mere omfattende tilgang ved hjælp af langlæst sekventering viste sig at være mere præcis end industristandardprotokoller såsom 16S-sekventering eller kortlæst sekventering, korrigering af fejl og ufuldstændige resulterer i mikrobeidentifikation genereret af disse metoder. Vigtigt, metoden giver en ny måde at forbinde mobile genetiske elementer til deres bakterieværter, giver videnskabsmænd mulighed for mere præcist at forudsige virulensen, antibiotikaresistens, og andre biologisk og klinisk kritiske træk ved individuelle bakteriearter og stammer.
"Det biomedicinske samfund har længe haft brug for en mikrobiomanalysemetode, der er i stand til at opløse individuelle arter og stammer med høj opløsning, " sagde Gang Fang, PhD, Adjunkt i genetik og genomiske videnskaber ved Mount Sinai, og seniorforfatter af papiret. "Vi fandt ud af, at DNA-methyleringsmønstre kan udnyttes som meget informative naturlige stregkoder for at hjælpe med at skelne mikrobielle arter fra hinanden, hjælpe med at knytte mobile genetiske elementer til deres værtsgenomer og opnå mere præcis mikrobiomanalyse."
I pilotprojekter, der bruger både syntetiske og virkelige mikrobiomprøver, videnskabsmænd var i stand til at skelne mellem selv nært beslægtede arter og stammer af bakterier. De brugte methyleringsmønstre til at forbinde relaterede DNA-sekvensdata, give mere holistisk information om individuelle organismer. Holdet validerede metoden i mikrobielle samfund med lav til middel kompleksitet, og er i øjeblikket ved at udvikle mere avancerede teknologier til effektivt at løse højkompleksitetssamfund såsom miljømikrobiomer.
"Dette projekt demonstrerer sofistikeringen og kraften i at analysere mange typer data sammen for at give indsigt, som ikke er mulig med mere forenklede tilgange, sagde Eric Schadt, PhD, Sema4 CEO, Dekan for præcisionsmedicin ved Sinai-bjerget, og en medforfatter af papiret. "Biologi er kompleks, og vores analyser skal nøjagtigt repræsentere denne kompleksitet, hvis vi håber at kunne implementere denne information til klinisk brug."
 Varme artikler
Varme artikler
-
 Hvornår slutter livet på Jorden?Bliver livet en fortid? Donald Nausbaum/Photographers Choice/Getty Images Der var en tid, hvor vores planet var blottet for liv. Intet svømmede gennem dets grumsede, blågrønne hav. Intet voksede på d
Hvornår slutter livet på Jorden?Bliver livet en fortid? Donald Nausbaum/Photographers Choice/Getty Images Der var en tid, hvor vores planet var blottet for liv. Intet svømmede gennem dets grumsede, blågrønne hav. Intet voksede på d -
 Urban Coopers høge udkonkurrerer deres naboer på landetCoopers Hawks i urbane Albuquerque, Ny mexico, er så succesrige, at de udkonkurrerer deres naboer på landet. Kredit:B. Millsap Afhængigt af om en art blomstrer i et bymiljø, bypopulationer af vild
Urban Coopers høge udkonkurrerer deres naboer på landetCoopers Hawks i urbane Albuquerque, Ny mexico, er så succesrige, at de udkonkurrerer deres naboer på landet. Kredit:B. Millsap Afhængigt af om en art blomstrer i et bymiljø, bypopulationer af vild -
 Undersøgelse identificerer sandsynlige scenarier for global spredning af ødelæggende afgrødesygd…Hvede inficeret med stilkrust. Kredit:CIMMYT stilk rust, opkaldt efter de sorte pustler, der inficerer plantestængler, forårsaget ødelæggende afgrødeepidemier og hungersnød i århundreder, før de b
Undersøgelse identificerer sandsynlige scenarier for global spredning af ødelæggende afgrødesygd…Hvede inficeret med stilkrust. Kredit:CIMMYT stilk rust, opkaldt efter de sorte pustler, der inficerer plantestængler, forårsaget ødelæggende afgrødeepidemier og hungersnød i århundreder, før de b -
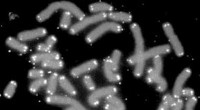 Sådan fungerer telomererTelomerer (i hvidt) dækker enderne af menneskelige kromosomer, beskytter de genetiske oplysninger mod skader. Billedet er tilladt af Human Genome Program Science fiction -klassikeren fra 1982 fra Bla
Sådan fungerer telomererTelomerer (i hvidt) dækker enderne af menneskelige kromosomer, beskytter de genetiske oplysninger mod skader. Billedet er tilladt af Human Genome Program Science fiction -klassikeren fra 1982 fra Bla
- Lagkage 2-D superledningsevne:Udvikling af ren 2-D superledningsevne i en bulk van der Waals supergi…
- Astronomer kortlægger interstellare støvkorn i Mælkevejen
- Kaspersky vil overføre infrastruktur ud af Rusland
- Hvorfor absorberer æggekartoner lyd?
- Hvordan musik og bevægelse kan hjælpe børn med at forstå matematik
- Tegn på liv ved ingenmandsland omkring den filippinske vulkan


