Den lyse side af et infektiøst protein:Stresssensorer fremmer gærcelleoverlevelse
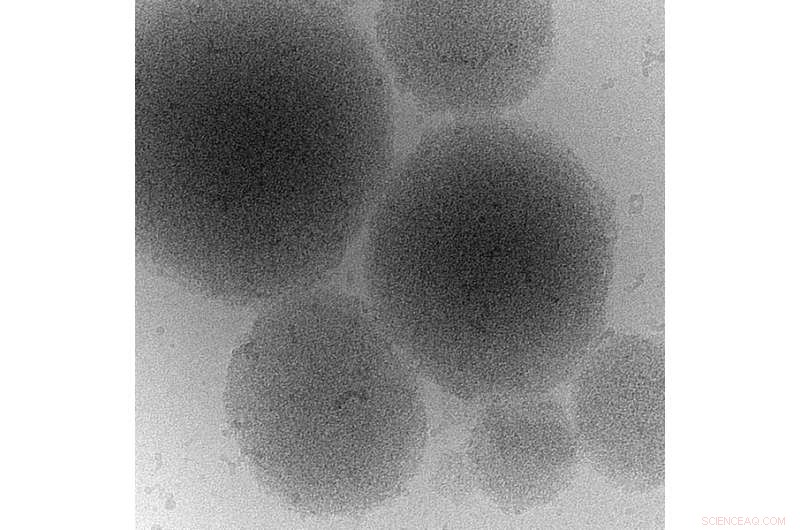
Kryo-elektronmikroskopibillede af et biomolekylært kondensat af et prionprotein. Kredit:MPI-CBG
Prioner er selvformerende proteinaggregater, der kan overføres mellem celler. Aggregaterne er forbundet med menneskelige sygdomme. Ja, patologiske prioner forårsager kogalskab og hos mennesker Creutzfeldt-Jakobs sygdom. Aggregeringen af prionlignende proteiner er også forbundet med neurodegeneration som ved ALS. Regionerne inden for prionlignende proteiner, der er ansvarlige for deres aggregering, blev kaldt prionlignende domæner. På trods af den vigtige rolle, som prionlignende domæner spiller i menneskelige sygdomme, en fysiologisk funktion er forblevet gådefuld. Forskere ved Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG), bioteknologicenteret i TU Dresden (BIOTEC), og Washington University i St. Louis, USA har nu for første gang identificeret en godartet, omend biologisk relevant funktion af priondomæner som proteinspecifikke stresssensorer, der tillader celler at tilpasse sig og overleve miljøbelastninger. Afdækning af den fysiologiske funktion er et væsentligt første skridt mod at lukke et hul i forståelsen af priondomænernes biologiske rolle og deres transformation til en patologisk sygdomsfremkaldende tilstand.
Opdagelserne blev offentliggjort i Videnskab .
Aggregeringen af prionlignende proteiner er forbundet med menneskelige sygdomme. Deres smitsomme adfærd kan sammenlignes med spredningen af en virusinfektion. Dette rejser spørgsmålet om, hvorfor evolution har holdt disse proteiner rundt:er disse sekvenser gode til noget? I deres undersøgelse, holdet omkring forskningsgruppeleder prof. Simon Alberti fra MPI-CBG fokuserede på gær prionproteinet Sup35, som har en lang historie som rollemodel for prionforskning. De fandt ud af, at prion-domænet i Sup35 fungerer som en stresssensor, der udløser dannelsen af beskyttende proteindråber og geler, når celler udsættes for barske forhold.
Når celler er stressede, fordi de er udsultet af næringsstoffer, deres energiniveau falder. Dette fører til et fald i den cytosoliske pH-værdi - cellerne forsures. Som svar, celledeling stopper, metabolismen lukker ned, og cellerne går i standby-tilstand. Når stressen er ovre, celler skal hurtigt omprogrammere deres stofskifte og genstarte vækst og deling. Professor Simon Alberti og hans kolleger fandt ud af, at domænet Sup35 prion er vigtigt for stressoverlevelse. "Vi fandt ud af, at celler, der mangler priondomænet, viser en vækstdefekt, når de kommer sig fra stress", opsummerer Titus Franzmann, undersøgelsens første forfatter. Forskerne opdagede, at priondomænet af Sup35 registrerer den sure pH-værdi i cytosolen og derefter driver dannelsen af proteindråber, der beskytter Sup35 mod skade. "For at opbevare proteinet kan dråberne endda rykke ind i en gelignende struktur", siger medforfatter Marcus Jahnel fra biofysikgruppen af prof. Stephan Grill ved BIOTEC. Disse proteindråber - der dannes i cytoplasmaet svarende til kondenserende vanddråber - kan opløses igen, gør det muligt for cellen at genbruge Sup35-proteinet, når det genstarter væksten. Derudover kolleger fra Washington University i St. Louis forudsagde sekvenserne af de aminosyrer, der er ansvarlige for, at Sup35 registrerer ændringer i den cytoplasmatiske pH-værdi. I denne sammenhæng, Rohit Pappu, Edwin H. Murty professor i biomedicinsk teknik ved Washington University, bemærkede, at:"Afsløring af de molekylære komponenter, der giver disse adaptive evner hos Sup35, har også vigtige konsekvenser for forståelse af celler på et molekylært niveau og vedtagelse af disse principper for opbygning af syntetiske systemer".
Fra et evolutionært synspunkt, Sup35-kondensaterne er virkelig interessante, da de er bevaret blandt fjernt beslægtede gær, der divergerede for næsten 400 millioner år siden. Dette tyder på, at dråbe- og geldannelse kan være en forfædres funktion af Sup35 priondomænet. Titus Franzmann konkluderer:"Undersøgelsen tyder på, at priondomæner er proteinspecifikke stresssensorer, der tillader celler at reagere på specifikke miljøforhold. På den måde vi kunne for første gang vise en positiv funktion af et priondomæne, der ofte kun har været forbundet med sygdomsfremkaldende aggregater. Så måske er det grunden til, at evolutionen har holdt dem så længe."
 Varme artikler
Varme artikler
-
 Døgn -uret sætter tempoet for plantevækstSkema, der repræsenterer niveauerne af de forskellige PRR -proteiner og aktiviteten af PIF -proteinet i løbet af 24 -timers cyklus. Nedenfor viser det, hvordan disse proteiner påvirker væksten af A
Døgn -uret sætter tempoet for plantevækstSkema, der repræsenterer niveauerne af de forskellige PRR -proteiner og aktiviteten af PIF -proteinet i løbet af 24 -timers cyklus. Nedenfor viser det, hvordan disse proteiner påvirker væksten af A -
 Forskere afslører en ny vej til at undertrykke virus-inducerede kræftformerDr Sudhakar Jha, Principal Investigator ved Cancer Science Institute of Singapore (til højre) og Deepa Rajagopalan, Ph.d.-studerende ved NUS (venstre), identificeret en ny molekylær vej, hvorved en tu
Forskere afslører en ny vej til at undertrykke virus-inducerede kræftformerDr Sudhakar Jha, Principal Investigator ved Cancer Science Institute of Singapore (til højre) og Deepa Rajagopalan, Ph.d.-studerende ved NUS (venstre), identificeret en ny molekylær vej, hvorved en tu -
 Er det en rettighed eller et privilegium at kende dit fulde genom?HowStuffWorks nu:Vil du lægge dit genom på din smartphone for $ 999? HowStuffWorks Dit genom er skrevet i dine celler, men er det et privilegium at have adgang til det? Indtil for nylig, genom -sek
Er det en rettighed eller et privilegium at kende dit fulde genom?HowStuffWorks nu:Vil du lægge dit genom på din smartphone for $ 999? HowStuffWorks Dit genom er skrevet i dine celler, men er det et privilegium at have adgang til det? Indtil for nylig, genom -sek -
 Din hjerne på: EmpatiHar du nogensinde bemærket, hvordan nogens positivitet og entusiasme er smitsom? Eller hvordan en andens smerte eller frygt også får dig til at føle bekymring? Det er empati på arbejdet. Ikke k
Din hjerne på: EmpatiHar du nogensinde bemærket, hvordan nogens positivitet og entusiasme er smitsom? Eller hvordan en andens smerte eller frygt også får dig til at føle bekymring? Det er empati på arbejdet. Ikke k
- Spildevandsnøgle til at løse den globale vandkrise:FN
- Forskere opdager nyt magnetisk element
- Enhed forvandler skaller af havdyr til kraft til medicinsk, augmented reality, mobiltelefonenheder
- Det er præcis et år siden Opportunity sendte denne sidste besked hjem - den 5. 111. Mars dag
- Orkanernes indvirkning på økosystemet i Puerto Rico
- Fossiliserede tænder blotter mangfoldigheden i uddøde sauropoddinosaurer


