Kipferl:Vejledning i forsvaret mod springgener
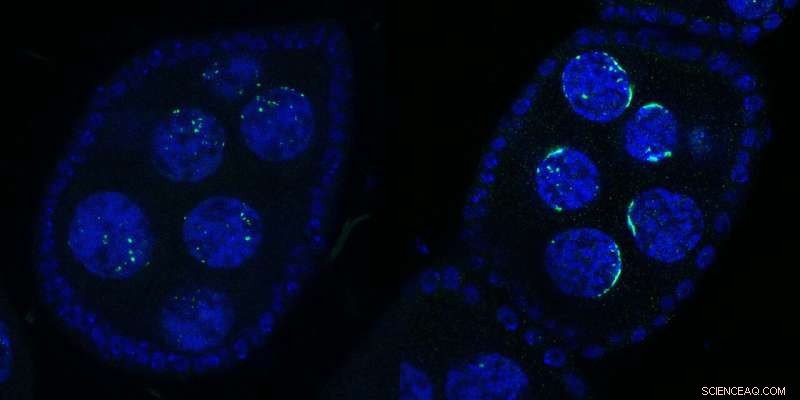
To Drosophila ægkamre indeholdende flere kerner:Vildtype (venstre) eller ved Kipferl-inaktivering (højre). DNA'et er vist i blåt og næsehorn i grønt. Ved mutation eller deletion af partnerproteinet Kipferl (til højre), mister Rhino sin affinitet for piRNA-klyngesekvenserne på tværs af genomet (grønne prikker i venstre panel), men sekvestreres af de pericentromeriske satellit-arrays (grøn halvmåne-lignende former i højre side) panel). Halvmåneformerne inspirerede navnet "Kipferl", navnet på et østrigsk wienerbrød. Kredit:Baumgartner/Brennecke/IMBA
En stor del af vores DNA består af egoistiske gentagne DNA-elementer, hvoraf nogle kan springe fra et sted i genomet til et andet, hvilket potentielt skader genomet. Forskere fra Institut for Molekylær Bioteknologi ved det østrigske videnskabsakademi (IMBA) beskriver, hvordan forskellige typer af gentagne DNA-elementer styres af den samme lyddæmpningsmekanisme i frugtflueæggestokke.
Centralt for deres resultater er et ukarakteriseret protein, som forskerne kaldte "Kipferl", som sikrer effektiv kontrol af springgener. Resultaterne tyder på, at forskellige egoistiske elementer konkurrerer om værtsgenomets forsvarssystem, og at Kipferl kan være den første af en række lignende virkende molekyler, der endnu ikke er blevet afsløret. Resultaterne er offentliggjort i eLife .
Omkring halvdelen af det menneskelige genom, og en femtedel af frugtfluens genom, er sammensat af genetiske parasitter, der ligner gener, der kan lave kopier af sig selv og indsætte sig selv i tilfældige områder af vores genom, hvilket potentielt kan forstyrre normal genekspression. Flere forsvarsmekanismer har udviklet sig for at holde disse såkaldte transposoner i skak.
En sådan mekanisme er et RNA-interferenssystem kaldet piRNA-vejen. PiRNA-vejen er en lille RNA-dæmpningsvej, der er bevaret i hele dyreriget, fra svampe til pattedyr. Denne lyddæmpningsmekanisme bruger piRNA'er genereret fra transposonrige sekvenser i DNA'et kaldet "piRNA-klynger".
piRNA'er er små RNA'er, der kobles med såkaldte Argonaute-proteiner i lyddæmpningsmaskineriet for at målrette transposonerne komplementært til deres sekvens. Derfor tjener disse piRNA'er som tegninger til at identificere og dæmpe transposoner med komplementære sekvenser i genomet, uanset hvor langt de var i stand til at springe.
Frugtfluen Drosophila melanogaster, hvor piRNA-vejen først blev identificeret, bruger et protein kaldet "Rhino" til at finde piRNA-klynger i genomet. Hvordan Rhino genkender piRNA-klyngerne i DNA'et forblev dog ukendt.
"Tidligere in vitro-data havde vist en affinitet af Rhino til et specifikt epigenetisk mærke, kromatinmodifikationen H3K9me3," siger IMBA-gruppeleder Julius Brennecke, den tilsvarende forfatter til undersøgelsen. Denne modifikation er en markør for "heterochromatin", en form for tætpakket DNA, hvor generne er dæmpet.
H3K9me3 er dog ikke specifik for piRNA-klynger, men findes også ofte i andre tætpakkede områder af genomet. Der er H3K9me3 bundet af det vigtigste heterochromatinprotein 1 (HP1), en nær slægtning til Rhino.
Hvorfor HP1 og Rhino binder til forskellige undergrupper af heterochromatin, selvom de begge har en sammenlignelig affinitet for den samme kromatinmodifikation, var længe uklart. "Uden et spørgsmål var H3K9me3 påkrævet, men ikke tilstrækkeligt til at forklare Rhinos binding til kromatin. Derfor vidste vi, at der skal være yderligere molekylære signaler, der hjælper med at målrette Rhino til piRNA-klynger," tilføjer Brennecke.
I søgningen efter denne molekylære cue katalogiserede holdet direkte interaktører af Rhino, på udkig efter et partnerprotein, der muligvis kunne guide Rhino til piRNA-klynger. Ved at bruge en kombination af genetiske, genomiske og billeddannende tilgange identificerede forskerne Rhinos "ledsager" i Drosophila-æggestokkene:et protein, der indeholder flere zink-fingerfolder, som de kaldte "Kipferl."
Kipferl binder sig ikke kun til næsehorn, men bruger også sine zink-fingre til den sekvensspecifikke binding til guanosin-rige DNA-motiver. Holdet fandt ud af, at de fleste piRNA-klynger er defineret gennem kombinationen af Kipferls specifikke DNA-bindingssteder med lokalt heterochromatin. På disse steder stabiliseres Rhinos interaktion med H3K9me3 epigenetiske mærker af Kipferl, hvilket forklarer, hvorfor Rhino kun binder til en lille del af al heterochromatin, der findes på tværs af genomet.
For at tilføje et kompleksitetsniveau vidste holdet, at Rhino ikke kun lokaliseres til piRNA-klynger. For nylig havde Rhino vist sig at binde sig til såkaldte "Satellite-arrays". Disse er gentagne sekvenser af ikke-kodende og ikke-transponerende DNA placeret tæt på kromosomernes centromerer.
"Vi så en slående effekt på næsehorn, når vi genererede fluer med mutant eller fraværende Kipferl og så på dem under mikroskopet," siger førsteforfatter Lisa Baumgartner, en doktorgradskandidat i Brennecke-laboratoriet på IMBA. Da Kipferl blev muteret, lokaliserede Rhino sig ikke længere til piRNA-klyngerne på tværs af genomet. I stedet akkumulerede det kraftigt ved genomiske satellit-arrays.
"I stedet for mindre prikker fordelt rundt om kernen, så vi næsehorn danne tydelige halvmåne-lignende former. Baseret på denne allerførste observation gav vi det nye protein navnet 'Kipferl' efter et populært croissantformet østrigsk wienerbrød. Vi fandt kun ud af meget senere, at disse strukturer svarede til Mega-base strækninger af satellit-arrays." Derfor viste forskerne, at Kipferl hjalp med at distribuere næsehorn korrekt til piRNA-klynger og undgå dets sekvestrering til satellit-arrays.
Rhino er et af de hurtigst udviklende proteiner i fluegenomet. Brennecke og hans team antager, at denne hurtige udvikling meget vel kan skyldes positivt evolutionært pres, der kommer fra satellit-arrays.
"Satellit-arrays transponerer ikke, men kan rekombinere. Men hvis de gør det på en ukontrolleret måde, kan hele kromosomarme gå tabt. Derfor kan satellit-arrays have brug for en kontrolmekanisme, der involverer næsehorn og andre piRNA pathway-komponenter for at hjælpe med at pakke dem ind i stramt heterochromatin. Dette kan være grunden til, at satellit-arrays ser ud til at ville sequestere alt det næsehorn, de kunne finde," forklarer Baumgartner.
Baumgartner mener, at Rhino og piRNA-vejen kan have meget forskellige roller i deres interaktioner med satellit-arrays eller piRNA-klynger og transposoner. "Hop og multiplikation af transposoner udgør en fare for funktionaliteten af genomet, hvilket gør det nødvendigt, at piRNA-vejen gør dem tavse," siger hun.
"Derfor er piRNA-vejen i transposonernes øjne den 'fjende', der forhindrer dem i at sprede sig gennem genomet. Satellitarrays har på den anden side blot brug for et ekstra kontrollag for at sikre, at de kan bevare deres høje kopi. antal uden at beskadige genomet gennem uønsket rekombination. Derfor ville jeg i satellit-arrayernes øjne forestille mig, at Rhino er en faktor, der sikrer deres overlevelse," uddyber hun.
Baseret på disse observationer og analyser antyder forskerne, at satellit-arrays muligvis bruger et andet partnerprotein som Kipferl til at hjælpe med at lokalisere næsehorn til deres DNA.
"For at imødegå sekvestreringen af Rhino af satellit-arrays, spekulerer vi i, at Kipferl kan have udviklet sig ud fra en nødvendighed for at hjælpe med at retargete Rhino til piRNA-klyngerne. Derfor tyder vores resultater på, at Rhino kan blive fanget i en krydsild af genetiske konflikter," siger Brennecke. Ydermere udtrykkes Rhino både i testikler og æggestokke hos frugtfluen, mens Kipferl kun udtrykkes i æggestokke. "Kipferl kan være den første af flere næsehornsvejledningsfaktorer, der endnu ikke er blevet afsløret," slutter Brennecke. + Udforsk yderligere
Hvordan celler hacker deres egne gener
 Varme artikler
Varme artikler
-
 Genomisk analyse afslører ægte oprindelse af sydamerikanske hundeEn flok buskhunde krydser et vandløb. Kredit:Diego Torres/Napo Wildlife Center Ecolodge Sydamerika har flere hundearter end noget andet sted på Jorden, og en overraskende ny UCLA-ledet genomisk ana
Genomisk analyse afslører ægte oprindelse af sydamerikanske hundeEn flok buskhunde krydser et vandløb. Kredit:Diego Torres/Napo Wildlife Center Ecolodge Sydamerika har flere hundearter end noget andet sted på Jorden, og en overraskende ny UCLA-ledet genomisk ana -
 Et træ, der ejer sig selv, vokser i Athen,Georgien Dette er teknisk set Træets søn, der ejer sig selv, selvom intet træ nogensinde har haft nogen juridiske rettigheder. Center for fortolkning af arealanvendelse/BRUGT UNDER KREATIVE FÆ
Et træ, der ejer sig selv, vokser i Athen,Georgien Dette er teknisk set Træets søn, der ejer sig selv, selvom intet træ nogensinde har haft nogen juridiske rettigheder. Center for fortolkning af arealanvendelse/BRUGT UNDER KREATIVE FÆ -
 RNA-opdagelse kan hjælpe med at booste plantevarme, tørketoleranceEn side-by-side sammenligning viser bedre varme- og tørketolerance i thale karseplanter, hvis niveau af et specifikt RNA blev øget. Kredit:Texas A&M AgriLife Research Texas A&M AgriLife Research-f
RNA-opdagelse kan hjælpe med at booste plantevarme, tørketoleranceEn side-by-side sammenligning viser bedre varme- og tørketolerance i thale karseplanter, hvis niveau af et specifikt RNA blev øget. Kredit:Texas A&M AgriLife Research Texas A&M AgriLife Research-f -
 Hvor dårlig er sort skimmel,Virkelig? Sort skimmel er vist på denne væg. Uanset farve, du vil fjerne skimmelsvamp fra dit hus. onebluelight/Getty Images Du vil ikke have skimmelsvamp i dit hjem. Sort, grøn, orange, gul
Hvor dårlig er sort skimmel,Virkelig? Sort skimmel er vist på denne væg. Uanset farve, du vil fjerne skimmelsvamp fra dit hus. onebluelight/Getty Images Du vil ikke have skimmelsvamp i dit hjem. Sort, grøn, orange, gul
- Observatoriet i Chile tager målinger i højeste opløsning af asteroide overfladetemperaturer nogen…
- Forudsigelse af menneskelig forældelse,
- Tusindvis af bevidst påsatte brande presser Brasiliens regnskov tæt på vendepunktet
- Det virkelige problem med giftig maskulinitet er, at den antager, at der kun er én måde at være m…
- Mænd ser rod – de bliver bare ikke dømt for det, som kvinder er
- Alkaline Vs. Basic


