Livets oprindelse i en RNA-lomme
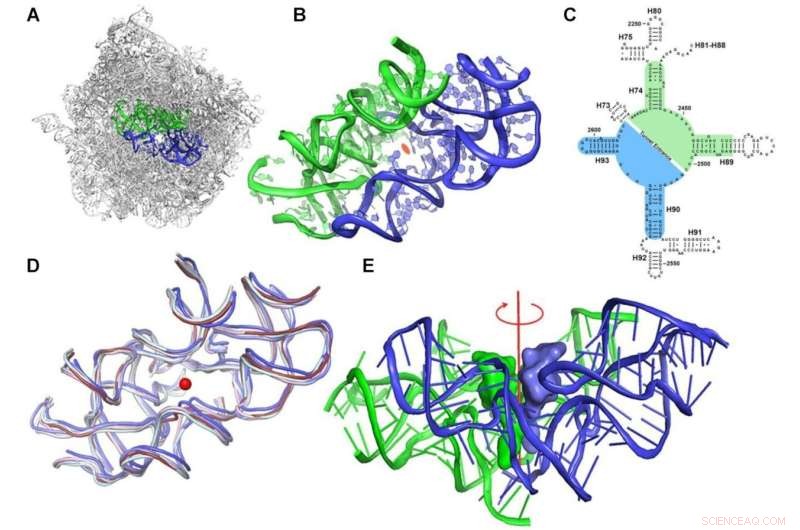
Protoribosom konceptet. (A) Det symmetriske område, markeret med blåt (A-reg) og grønt (P-reg), inden for rRNA-stilladset af den store ribosomale underenhed af D. radiodurans (PDBID 1NKW). (B) Et nærbillede af protoribosomet, hvor de 2-fold semisymmetriske dele er vist. Udsigten er langs pseudo-symmetri 2-fold aksen. Midten af PTC er markeret med en orange ellipse. (C) Et todimensionelt strukturdiagram af rRNA'et, der omgiver PTC'en, der viser symmetrien. A- og P-reg-nukleotiderne er markeret ved hjælp af henholdsvis blå og grøn baggrund. 23S rRNA helix-numre er markeret med sorte etiketter. Nukleotidnummerering ifølge E. coli er vist. (D) Overlejring af den symmetriske region af ribosomstrukturer fra forskellige organismer, der er repræsentative for forskellige fylogenetiske klasser:bakteriel (D. radiodurans og E. coli i henholdsvis skifer og lyseblå), gær (S. cerevisiae i bleg cyan), parasit ( L. donovani i blåt) og humane ribosomer (cytosoliske og mitokondrielle i henholdsvis rubin og lys pink) (PDBID, der anvendes er henholdsvis:1NKW, 4V4Q, 4V7R, 3JCS, 4U60 og 3J7Y). Den centrale røde prik repræsenterer positionen af den formodede symmetriakse, som er vinkelret på planet. (E) CCA-3'-enden af A-site og P-site tRNA'er blev overlejret på den symmetriske region af det bakterielle ribosom (PDBID 1NKW). Visningen er vinkelret på den semisymmetriske 2-foldede akse, vist med rødt. Kredit:Nukleinsyreforskning (2022). DOI:10.1093/nar/gkac052
Denne historie begynder for flere milliarder år siden. Der er kun kemi, ingen biologi - det vil sige, der findes masser af kemiske forbindelser på Jorden, men liv er endnu ikke dukket op. Så, blandt myriader af tilfældigt selv-samlede kemiske strukturer, afslører én lillebitte RNA-molekylær maskine sig som perfekt egnet til at skabe bindinger mellem aktiverede aminosyrer, byggestenene i fremtidige proteiner.
Det er et vendepunkt i historien om vores planet:Syntesen af proteiner, biologiske molekyler, der er essentielle for liv, kan nu begynde. Prof. Ada Yonath og hendes team ved Weizmann Institute of Science mener, at de har genskabt det øjeblik i laboratoriet og viser, hvordan det kunne være sket. Med hensyn til den oprindelige maskine til fremstilling af peptidbindinger, opdagede de, at den stadig er til stede i stort set alle celler i alle levende organismer, fra bakterier til planter og dyr, inklusive os selv.
Teorien bag holdets projekt blev født for omkring 20 år siden ud fra opsigtsvækkende fund gjort i Yonaths laboratorium i løbet af at bestemme strukturen og funktionen af ribosomet - forskning, der senere ville give hende Nobelprisen i kemi i 2009. Ribosomet udfører en af livets kerneprocesser:fremstilling af proteiner baseret på informationen i DNA.
"Vi opdagede en overraskende funktion i strukturen af denne proteinfremstillingsmaskine," siger Dr. Anat Bashan, en senior videnskabsmand i Yonaths laboratorium i Weizmanns kemiske og strukturelle biologiafdeling. "Ribosomet er et enormt makromolekyle, der slet ikke er symmetrisk; i sit hjerte indeholder det to semisymmetriske elementer, der er forbundet til en lomme."
Yonath siger, at de "blev særligt slået af det faktum, at denne lomme findes i ribosomer af alle organismer. Og det er her, al handling finder sted - det er her alle peptidbindinger, der skaber kæden af sammenkædede aminosyrer, der udgør et protein Det er derfor, dette grundlæggende maskineri ser ud til at have bestået uændret gennem hele evolutionen."
Mød protoribosomet:Det er, hvad forskerne kalder denne lommelignende struktur. De antog, at protoribosomet er forfaderen til alle moderne ribosomer, en gammel maskine, der går tilbage til førlivsperioden. I sammenligning med cellens størrelse er protoribosomet ret lille. Det består af RNA-molekyler, der omfatter omkring 120 nukleotider, omkring 60 for hver af dets to semisymmetriske komponenter, som tegner sig for mindre end 5 procent af det moderne ribosoms dimensioner:omkring 4.500 nukleotider i bakterier og næsten 6.000 i mennesker
Sådan udviklede scenariet sig ifølge Yonath og hendes team:
Protoribosomet opstod, da en flok RNA-nukleotidkæder selv samlede sig i to semisymmetriske vægge, blev koblet sammen for at skabe en lomme. Uendelige andre strukturer må ved et uheld have samlet sig selv omkring samme tid, men protoribosomet overlevede, "ved at blive viralt," ser det ud til, fordi det udførte nyttige funktioner, og takket være RNA's iboende egenskaber kunne det selvreplikere.
Når to aktiverede aminosyrer tilfældigvis interagerer med hinanden i denne lomme, dannede de en binding, lettet af de fremherskende kemiske forhold. Disse aminosyrer kan være opstået på Jorden eller, som nogle hævder, landet med asteroider fra det ydre rum, men deres oprindelse er irrelevant for vores historie. Det, der betyder noget, er, at inden for protoribosomet kan to aktiverede aminosyrer binde sig til hinanden. Senere forenede en sådan bindingsdannelse mange flere aminosyrer og forbandt dem til en kæde.
Det var begyndelsen på proteiner, hvoraf nogle så viste sig nyttige til at stabilisere og styrke selve protoribosomet. Proteinerne blev ved med at tilføje til protoribosomets struktur, hvilket gjorde det muligt for det at udvikle sig til den sofistikerede proteinfremstillingsfabrik, det er i dag. "Et moderne ribosom kan beskrives som et løg, med protoribosomet i centrum, omgivet af flere lag, der blev tilføjet under evolutionen," siger Yonath.
Med tiden ville proteinproduktionen blive effektiv nok til at skabe kæder op til tusindvis af aminosyrer i længden, og til at gøre det i henhold til instruktionerne skrevet i den genetiske kode. De titusindvis af proteiner i den menneskelige krop udfører alle forskellige funktioner, fra hormoner som insulin, til antistoffer i immunsystemet, til strukturelle komponenter i celler og væv såsom hæmoglobin eller kollagen i huden. Og de begyndte alle med de bånd, der engang blev dannet ved et tilfælde inden for protoribosomet.
Spol et par milliarder år frem. Teorien var blevet opretholdt af beregninger, deduktioner og dimeriseringseksperimenter, hvor forskerne skabte RNA-dimere konstruktioner, der efterlignede det foreslåede protoribosom. Men indtil for nylig forblev teoriens principper, ja, stort set teoretiske. Nu, i en ny undersøgelse ledet af postdoc-stipendiat Dr. Tanaya Bose i Yonaths laboratorium, har forskerne givet det eksperimentel støtte.
Bose og kolleger satte sig for at undersøge, om et laboratoriesyntetiseret protoribosom ville være tilstrækkeligt stabilt til at overleve og udføre sin formodede bindingsdannelse, det vil sige, de ønskede at finde ud af, om det faktisk var i stand til denne opgave. Hun og de andre medlemmer af Yonaths team skabte et design til et potentielt protoribosom ved at analysere de lommelignende strukturer i hjertet af flere bakterielle ribosomer. Bose forberedte derefter disse protoribosomale konstruktioner i en laboratorieskål.
Dernæst kom det afgørende skridt:at kontrollere, om de lommelignende dimer-konstruktioner kunne skabe bindinger mellem aminosyrer. Efter at have blandet konstruktionerne med en opløsning, der indeholdt aktiverede aminosyresubstrater, samt forskellige salte og andre reagenser, udsatte Bose reaktionsprodukterne for en række tests, inklusive massespektrometrianalyse.
Til holdets glæde klarede de syntetiske protoribosomer skabt i laboratoriet opgaven. "Peptidbindingsdannelse er den mest vitale aktivitet i enhver celle, og vi har vist, at den kan finde sted i et protoribosom," siger Bose.
"Det foreslåede protoribosom kan være det manglende led mellem en RNA-domineret verden - en der kan have eksisteret før proteiner og DNA dukkede op - og liv, der er baseret på proteiner og nukleinsyrer, som vi kender det i dag," siger Bashan. P>
Forskningen blev offentliggjort i Nucleic Acids Research . + Udforsk yderligere
Bindinger fra fortiden:En rejse gennem historien om proteinsyntese
 Varme artikler
Varme artikler
-
 Leder efter CRISPR-schweizisk hærsknivRepræsentation af CRISPR -protein Cpf1. Klasse 2 CRISPR Cas -komplekserne, herunder Cas9 og Cpf1, har stor alsidighed, da et enkelt protein styret af en guide RNA er i stand til at genkende og skære e
Leder efter CRISPR-schweizisk hærsknivRepræsentation af CRISPR -protein Cpf1. Klasse 2 CRISPR Cas -komplekserne, herunder Cas9 og Cpf1, har stor alsidighed, da et enkelt protein styret af en guide RNA er i stand til at genkende og skære e -
 At se mad kan have lokket fisk til landDenne model fra siden viser en fossil fisk kendt som Tiktaalik i grumsede farvande for 385 millioner år siden. Det kigger ud over vandlinjen gennem øjne, der er placeret oven på kraniet. Malcolm A. Ma
At se mad kan have lokket fisk til landDenne model fra siden viser en fossil fisk kendt som Tiktaalik i grumsede farvande for 385 millioner år siden. Det kigger ud over vandlinjen gennem øjne, der er placeret oven på kraniet. Malcolm A. Ma -
 Byafgrøder kan have højere udbytter end konventionelt landbrugBylandbrug kan bruge både grønne områder, som denne fælleshave, og grå rum såsom tage og lodrette vægge til at dyrke mad til byen. Kredit:Roots in the City Community Garden i Liverpool Efterhånden
Byafgrøder kan have højere udbytter end konventionelt landbrugBylandbrug kan bruge både grønne områder, som denne fælleshave, og grå rum såsom tage og lodrette vægge til at dyrke mad til byen. Kredit:Roots in the City Community Garden i Liverpool Efterhånden -
 Har et videospil helbredt hiv?Dette er et af de proteinpuslespil, som spillere kan stå over for, når de spiller Foldit. Klik her for at se et større billede af dette billede. Skærmbillede høflighed The Center for Game Science, Dat
Har et videospil helbredt hiv?Dette er et af de proteinpuslespil, som spillere kan stå over for, når de spiller Foldit. Klik her for at se et større billede af dette billede. Skærmbillede høflighed The Center for Game Science, Dat
- Forskning afslører, hvordan orden først opstår i flydende krystaller
- Hvordan man laver en arkitektonisk tegning
- Din brændeovn påvirker klimaet mere, end du måske tror
- At gøre klimamodeller til open source gør dem endnu mere nyttige
- Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsproces
- Undersøgelse viser, at narkotikaaktivitet øger kriminalitet i kvarterer uanset stabilitet, rigdom


