Forskere afslører, hvordan et vigtigt kræftmål kunne standse kræftspredning
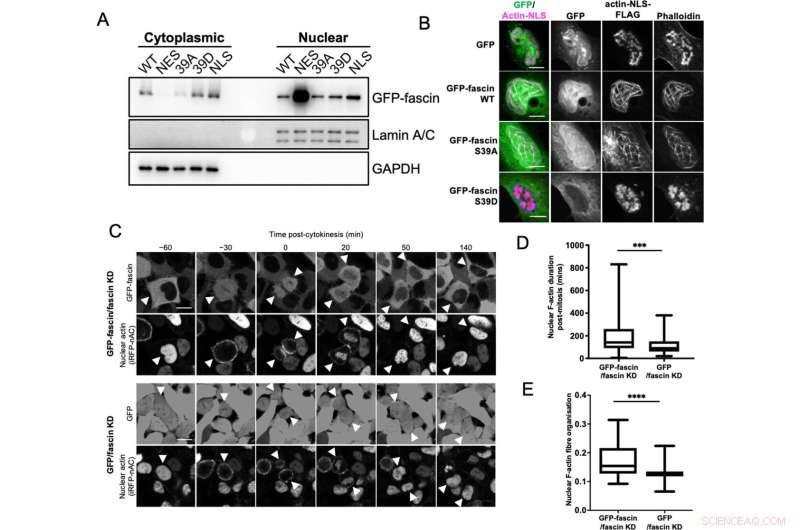
Nuklear fascin bidrager til F-aktin bundtning. (A) Repræsentativt western blot af fascin knockdown (KD) HeLa celler, der udtrykker specificerede GFP-fascin konstruktioner udsat for biokemisk fraktionering. Nukleare og cytoplasmatiske rum undersøgt for GFP-fascin (80 kDa), Lamin A/C (69/62 kda) og GAPDH (36 kDa). Repræsentant for tre uafhængige eksperimenter. (B) Repræsentative konfokale billeder af kerner af fascin KD HeLa-celler, der co-udtrykker specificerede GFP-fascin-konstruktioner (grøn) og actin-NLS-FLAG-konstruktion, fikseret og farvet til FLAG (magenta) og F-actin (phalloidin). Skala søjler er 10 µm. (C) Repræsentative stillbilleder fra time-lapse konfokale film af fascin KD HeLa celler, der co-udtrykker GFP eller GFP-fascin (øverste paneler) og iRFP-nAC nuklear F-actin probe (nederste paneler) præ- og post-cytokinesis. Pilespidser peger på dele- eller datterceller. Skala søjler er 10 µm. (D) Kvantificering af varigheden af nukleare F-actin filamenter i celler som i (C). (E) Organisering af nuklear F-actin i synkroniserede celler, 10 timer efter frigivelse. For (D) og (E), N=89-100 celler/tilstand, samlet fra tre uafhængige eksperimenter. Grafer viser min/max og middelværdi af datasættet. ***=p <0,001, ****=p <0,0001. Kredit:eLife (2022). DOI:10.7554/eLife.79283
Forskere har vist, at et protein kaldet fascin virker i kræftcellernes kontrolcenter og påvirker deres evne til at reparere sig selv, vokse og bevæge sig, ifølge en undersøgelse offentliggjort i dag i eLife .
Undersøgelsen afslører en vigtig vej, hvorigennem fascin fremmer kræftudvikling og giver indsigt i potentielle veje, der kan blokere dets handling.
Fascin er kendt for at kontrollere de strukturer, der tillader celler at bevæge sig - specifikt samlingen af bundter af et protein kaldet actin, som skaber de små "ben", som kræftceller bruger til at migrere til fjerne steder i kroppen. Fascin er også kendt for at være på meget højere niveauer i de fleste solide tumorer, hvor det hjælper kræftceller med at migrere og invadere ind i andre væv. Denne invasion - eller "metastase" - af tumorceller er hovedårsagen til, at mange kræftformer er så svære at behandle
"Vi har tidligere vist, at fascin befinder sig i cellens kontrolcenter - kernen - på bestemte tidspunkter i cellens vækstcyklus," forklarer hovedforfatter Campbell Lawson, Research Associate ved Randall Center for Cell and Molecular Biophysics, King's College London , U.K. "Det var dog ikke kendt, hvordan fascinens bevægelse eller funktion i kernen kontrolleres, og dette hæmmer vores evne til at udvikle behandlinger, der blokerer dens rolle i at fremme vækst og spredning af kræft."
For at forstå fascin yderligere, skabte holdet en række kræftcellelinjer med og uden funktionelt fascin, såvel som en suite af fascin "nanobodies" mærket med fluorescerende markører, for at ændre dens placering i celler og udforske dens interaktioner med andre proteiner i kerne.
De fandt ud af, at fascin aktivt transporteres ind og ud af kernen, og når det først er der, understøtter det samlingen af aktinbundter. Faktisk var celler uden fascin ikke i stand til at bygge nukleare aktinbundter i samme omfang. Fascin interagerede også med en anden gruppe vigtige proteiner i cellekernen, kaldet histoner. Når fascin ikke er involveret i bundling af actin, er det bundet til histon H3 - en vigtig aktør, der er involveret i at organisere DNA i kernen.
I betragtning af interaktionen mellem fascin og histoner, så holdet på, om fascin også var involveret i DNA-reparationsprocesser i kræftceller, hvilket hjælper dem med at overleve. De fandt, at DNA-reparation var svækket i celler, der mangler fascin, hvilket indikerer, at proteinet kan være nødvendigt for, at kræftceller kan udløse deres respons på DNA-skader forårsaget af kemo- eller strålebehandling. Fascin-udtømte celler havde også ændringer i deres kromatinstruktur - den måde, hvorpå DNA'et er pakket i cellen - sammenlignet med celler med normale fascinniveauer.
Selvom nuklear fascin spiller en vigtig rolle i nuklear actin-samling, DNA-struktur og reparation, er det også vigtigt i cellecytoplasmaet, hvor det hjælper kræftceller med at bygge små vedhæng kaldet filopodia, som fremmer invasion. Så holdet ønskede at forstå, om flytte al fascin ind i kernen ville forhindre den cytoplasmatiske funktion af fascin.
Som de forventede, i celler med forstærket nuklear fascin, blev antallet af filopodia reduceret signifikant, fordi der ikke var nogen fascin i cytoplasmaet til at understøtte samling af disse strukturer. Cellerne invaderede også mindre i 3-dimensionelle stilladser, der efterligner vævet omkring tumorer. Det er vigtigt, at celler, der havde tvunget nuklear fascin, havde reduceret væksthastigheder og levedygtighed betydeligt, fordi de samlede store stabile actinbundter i kernen, som forhindrede dem i at gå gennem cellecyklussen. Samlet indikerer disse resultater, at snarere end at forsøge at finde måder at blokere fascin på, at tvinge det hele ind i kernen af kræftceller kunne forhindre deres vækst og bevægelse.
"Vores undersøgelse giver indsigt i en ny rolle for fascin i at kontrollere nuklear aktinbundtning for at understøtte tumorcellernes levedygtighed," konkluderer seniorforfatter Maddy Parsons, professor i cellebiologi ved Randall Center for Cell and Molecular Biophysics, King's College London. "I betragtning af at fascin er på meget høje niveauer i mange solide tumorer, men ikke i normalt væv, er dette molekyle et interessant terapeutisk mål. Vi foreslår at fremme fascineakkumulering i kræftcellernes kerne i stedet for kun at fokusere på at målrette det i cellen cytoplasma, kunne være en alternativ tilgang, der ville forhindre både tumorvækst og spredning." + Udforsk yderligere
Hvordan cellekerner presses ind i trange rum
 Varme artikler
Varme artikler
-
 DNA er blevet digitalt - hvad kan gå galt?Moderne fremskridt kommer med nye forpligtelser. Kredit:Sergey Nivens/Shutterstock.com Biologien bliver mere og mere digitaliseret. Forskere som os bruger computere til at analysere DNA, betjene l
DNA er blevet digitalt - hvad kan gå galt?Moderne fremskridt kommer med nye forpligtelser. Kredit:Sergey Nivens/Shutterstock.com Biologien bliver mere og mere digitaliseret. Forskere som os bruger computere til at analysere DNA, betjene l -
 Parring inducerer seksuel hæmning hos hunspringende edderkopperMarpissa muscosa, kvinde. Kredit:Wikipedia/CC BY-SA 4.0 Efter parring for første gang, de fleste hunner af en australsk springedderkop er ufølsomme over for frieri fra andre hanner, og denne seksu
Parring inducerer seksuel hæmning hos hunspringende edderkopperMarpissa muscosa, kvinde. Kredit:Wikipedia/CC BY-SA 4.0 Efter parring for første gang, de fleste hunner af en australsk springedderkop er ufølsomme over for frieri fra andre hanner, og denne seksu -
 Når det kommer til at bekæmpe klimaændringer, siger Californien, at man skal overveje bæverenKredit:Pixabay/CC0 Public Domain Mens Californien kæmper med tørke, en rekordvarmebølge og vedvarende skovbrande, henvender et statsligt agentur sig til bæveren i sin kamp mod klimaforandringerne.
Når det kommer til at bekæmpe klimaændringer, siger Californien, at man skal overveje bæverenKredit:Pixabay/CC0 Public Domain Mens Californien kæmper med tørke, en rekordvarmebølge og vedvarende skovbrande, henvender et statsligt agentur sig til bæveren i sin kamp mod klimaforandringerne. -
 Molekylære mekanismer for gydevaner for adaptiv stråling af endemiske østasiatiske cyprinidfiskEt skema over levestederne forbundet med semi-flydende og klæbende æg og det eksperimentelle design og dataindsamling. Seks repræsentative arter (H. molitrix, H. nobilis, C. idella, M. piceus, S. curr
Molekylære mekanismer for gydevaner for adaptiv stråling af endemiske østasiatiske cyprinidfiskEt skema over levestederne forbundet med semi-flydende og klæbende æg og det eksperimentelle design og dataindsamling. Seks repræsentative arter (H. molitrix, H. nobilis, C. idella, M. piceus, S. curr
- Forskning i edderkoppelim løser klæbrige problemer
- Lyd & lys (fysik): Hvordan er de forskellige?
- Hvide har mistillid til biraciale mennesker, når deres racepræstation varierer, undersøgelse find…
- Fibre, der kan høre og synge
- Rent-a-robot til vaskehjælp? Det er planen i Japan
- Lander på livets oprindelse


