Virus omkobler værtscellulært maskineri for at maksimere viral produktion
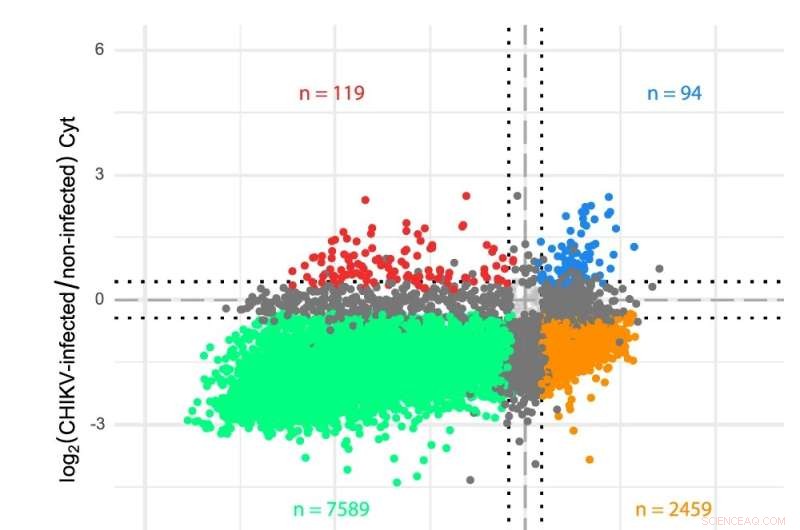
et skema af CHIKV RNA-genom. b Transkriptomanalyser af cytosol (Cyt) og ER-kompartmenter i CHIKV-inficerede celler. Gener blev plottet i overensstemmelse med deres log2-fold ændringer i CHIKV-inficerede vs. ikke-inficerede celler for begge translationsrum. Sekvenseringslæsningerne blev analyseret ved hjælp af en brugerdefineret transkriptomannotation, og differentiel ekspression blev bestemt via limma-voom (se Metoder). Farver angiver gener, der er signifikant (FDR < 0,05) nedregulerede i begge rum (grøn), opregulerede i begge rum (blå), op- eller nedregulerede i kun ét rum (mørkegrå) eller viser modsatrettede adfærd i de to rum (orange og rød). Stiplede linjer angiver log2-fold ændringer på ±0,433 (dvs. en 35 % ændring i begge retninger) brugt som minimumstærskel til at erklære mRNA-niveauer som ændrede. HEK 293T-celler blev inficeret ved en MOI på 4, og prøver blev indsamlet 12 timer efter infektion. Tre uafhængige replikater blev udført for hver tilstand. Kredit:Nature Communications DOI:10.1038/s41467-022-31835-x
Molecular Virology Research Group ved Pompeu Fabra University (UPF) har i samarbejde med Epitranscriptomics and RNA Dynamics-gruppen fra Center for Genomic Regulation (CRG) opdaget en ny mekanisme, hvorved virus modificerer cellulært maskineri for bedre at kunne læse instruktionerne i genomet af den invaderende virus og dermed producere store mængder af viralt afkom. Undersøgelsen er blevet offentliggjort i Nature Communications og blev ledet af Juana Díez.
Gener indeholder den information, der kræves til dannelsen af proteiner, komplekse molekyler, der er essentielle for livet, dannet af aminosyrer. Læsningen af denne information foregår i to hovedfaser, hvor den første er transkription, hvor informationen om genet (DNA) overføres til et molekyle kaldet messenger RNA (mRNA). mRNA består af en "tekst" dannet af tripletter af nukleotider (bogstaverne GCT, CAT osv.). Hver triplet svarer til en aminosyre. Den anden fase er translation, hvor et molekyle kaldet transfer RNA (tRNA) genkender hver triplet og fungerer som en translator ved at bringe den tilsvarende aminosyre. Proteiner opbygges via denne proces.
Der er 61 kodoner og 20 aminosyrer, og så mange tripletter koder for den samme aminosyre. Hver organisme bruger fortrinsvis en af disse tripletter (optimal triplet), fordi den har en højere koncentration af tRNA'et, der genkender denne triplet. Når "teksten" af mRNA'et er beriget med optimale tripletter, vil proteinerne blive genereret hurtigt og effektivt, mens når de beriges i ikke-optimale tripletter, vil effektiviteten af ekspressionen falde, fordi de relaterede tRNA'er er knappe.
Vira er meget enkle, og for at formere sig og udtrykke deres proteiner skal de kapere værtens cellulære maskineri. Virus genererer deres eget mRNA i de celler, de inficerer, som sidstnævnte læser og genererer virale proteiner for at producere flere vira. Men mRNA'erne fra mange vira, inklusive SARS-CoV-2 og vira, der overføres af myg, dengue, zika og chikungunya, er beriget med ikke-optimale tripletter og udtrykker stadig virale proteiner med stor effektivitet. "For at løse dette dilemma har vi brugt chikungunya-virussen som model, fordi dens genom formerer sig ved ekstremt høje niveauer," forklarer Jennifer Jungfleisch og René Böetcher, medforfattere til undersøgelsen.
"Vores resultater viser for første gang, at vira modificerer værts-tRNA'et for at tilpasse værtsoversættelsesmaskineriet til teksten af det virale mRNA," siger Marc Talló, også medforfatter af artiklen. "Med andre ord inducerer virusinfektionen en sprogændring i cellen, så den udtrykker virusproteinerne meget effektivt. Da virale proteiner er essentielle for produktionen af vira, vil denne ændring i sidste ende være ansvarlig for at generere et stort antal vira. i den inficerede celle," tilføjer han.
"Selvom undersøgelsen har fokuseret på chikungunya-virussen, er vores forslag, at modifikationen af tRNA'er induceret af viral infektion er en generel mekanisme efterfulgt af mange vira," forklarer Juana Díez, fuld professor ved UPF-afdelingen for medicin og biovidenskab.
"Derudover giver vores resultater et grundlag for at betragte tRNA-regulering som et nyt og lovende terapeutisk mål for udviklingen af bredspektrede antivirale midler, der er effektive mod flere vira," slutter Díez. Undersøgelsen involverede også forskningsgruppen koordineret af Eva María Novoa ved CRG, og de andre forfattere er Gemma Pérez-Vilaró og Andres Merits (Institute of Technology, University of Tartu). + Udforsk yderligere
Virus tilpasser sig 'menneskelige cellers sprog' for at kapere proteinsyntese
 Varme artikler
Varme artikler
-
 Hajer udviklede flylignende egenskaber, der passer til levestederJean Potvin, Ph.d., fysiker ved Saint Louis University. Kredit:Saint Louis University / Ellen Hutti I et papir udgivet i Proceedings of the Royal Society B:Biologiske videnskaber , forskere rapp
Hajer udviklede flylignende egenskaber, der passer til levestederJean Potvin, Ph.d., fysiker ved Saint Louis University. Kredit:Saint Louis University / Ellen Hutti I et papir udgivet i Proceedings of the Royal Society B:Biologiske videnskaber , forskere rapp -
 Undersøgelse viser, at klimaændringer vækker humlebierne tidligere fra vinterdvalen, hvilket brin…Konceptuel repræsentation af, hvordan klimaændringseffekter kan afbødes via et intervalskifte. Kredit:Biological Conservation / University of Ottawa Ny forskning fra University of Ottawa har fundet
Undersøgelse viser, at klimaændringer vækker humlebierne tidligere fra vinterdvalen, hvilket brin…Konceptuel repræsentation af, hvordan klimaændringseffekter kan afbødes via et intervalskifte. Kredit:Biological Conservation / University of Ottawa Ny forskning fra University of Ottawa har fundet -
 Undersøgelse fortæller om græskarfarvede zombierZombie Amphipods:Når saltmosen amphipod Orchestia grillus er inficeret af parasitten Levinseniella byrdi, den udvikler et orange eksoskelet og forsømmer at skjule sig for rovdyr. Uinficerede amfipoder
Undersøgelse fortæller om græskarfarvede zombierZombie Amphipods:Når saltmosen amphipod Orchestia grillus er inficeret af parasitten Levinseniella byrdi, den udvikler et orange eksoskelet og forsømmer at skjule sig for rovdyr. Uinficerede amfipoder -
 Planter, der trækker nitrogen fra den tynde luft, trives i tørre miljøerMesquite-planter, såsom dette eksemplar af Prosopis velutina, er almindelige komponenter i ørkenfloraen, delvis på grund af deres symbiotiske forhold til bakterier, der gør dem i stand til at få adgan
Planter, der trækker nitrogen fra den tynde luft, trives i tørre miljøerMesquite-planter, såsom dette eksemplar af Prosopis velutina, er almindelige komponenter i ørkenfloraen, delvis på grund af deres symbiotiske forhold til bakterier, der gør dem i stand til at få adgan
- Fluorescerende polymer registrerer spor af eksplosive enheder
- Levende sensor kan potentielt forhindre miljøkatastrofer fra brændstofspild
- Hvad er multiverset, og eksisterer det virkelig?
- Hvorfor er Wave Rock formet som en bølge?
- Britiske parlamentsmedlemmer beder Facebooks Zuckerberg om at vidne på datarække
- Samsung arbejder på bærbar computer med foldbar skærm


