Forskere undersøger virkningerne af tau-proteiner på mikrotubuli i nerveceller
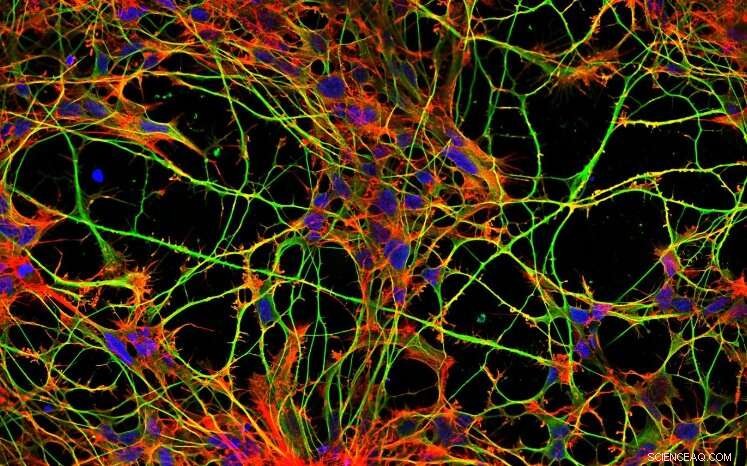
Nerveceller i vævskultur. Cellekerner i blåt, mikrotubuli i grønt, mikrofilamenter i rødt. Kredit:Tereza Humhalová
Tau-proteinet er en vigtig faktor forbundet med udviklingen af humane neurodegenerative sygdomme, herunder Alzheimers sygdom. Alligevel er der stadig meget, vi ikke ved om tau og andre lignende proteiner. De seneste opdagelser kommer fra arbejdet i et internationalt team, herunder medforfattere fra Det Naturvidenskabelige Fakultet ved Charles University i Prag, Lenka Libusova, Ph.D. og kandidatstuderende Tereza Humhalová. Studiet er blevet offentliggjort i Nature Chemical Biology . Det viser, at tau-protein kan danne belægninger eller hylstre på cytoskeletstrukturer i cellen kaldet mikrotubuli. Disse ændrer efterfølgende egenskaberne af de coatede mikrotubuli og forhindrer også passage af visse molekylære motorer, der giver intracellulær transport blot ved at bevæge sig langs mikrotubulierne.
Mikrotubuli er tynde rør inde i celler, der tjener som veje til transport af forskellig last (vesikler, mitokondrier, andre mikrotubuli, proteinkomplekser) fra et sted i cellen til et andet. I mindre celler fungerer denne transport over korte afstande, men i celler, der generelt er store eller aflange i én retning, skal der også sørges for transport over lange afstande. Nerveceller med deres forlængelser er et typisk eksempel på celler, hvor mikrotubuli sørger for transport af last ofte over afstande på mange centimeter. Men hvis mikrotubuli-banerne er beskadigede og/eller transportprocesserne ikke forløber korrekt, kan neurodegenerativ sygdom udvikle sig.
De proteiner, der binder til mikrotubuli, omtales samlet som MAP'er (et akronym afledt af "mikrotubuli-associerede proteiner"). MAP'er er meget vigtige spillere i cellens cytoskeletorkester, da deres binding påvirker mikrotubulus stabilitet, sikrer forankring af mikrotubulus netværket til den cytoplasmatiske membran eller sammenkobling med andre cytoskeletale strukturer. Især MAP2- og tau-proteiner, som tilhører samme proteinfamilie, danner beskyttende hylstre på mikrotubuli. De kappebeskyttede dele er modstandsdygtige over for de enzymer, der nedbryder mikrotubuli.
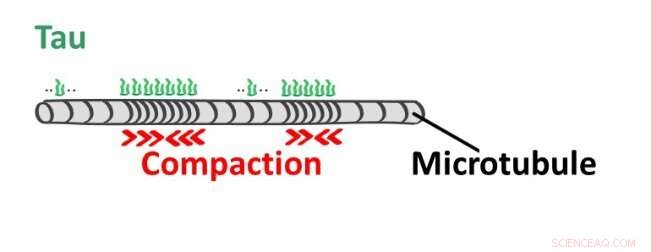
Kredit:Charles University
Nyudgivet arbejde af to tjekkiske grupper, ledet af Dr. Zdeněk Lánský fra Institut for Bioteknologi i CAS i BIOCEV-centret og Dr. Lenka Libusová fra Det Naturvidenskabelige Fakultet, Charles University, Prag, i samarbejde med forskere fra University of Californien (UC Davis), viser, at MAP2- og tau-proteiner forårsager endnu mere ved deres binding til mikrotubuli. Hvis de dækker en del af mikrotubuli med deres kooperativt bundne molekyler som en belægning, så inducerer de også en ændring i mikrotubulus struktur i den del. Mikrotubuli vil forkortes uden at frigive nogen bygningsenhed, kun blive mere kompakt i det belagte område.
Interessant nok er forholdet mellem tilstedeværelsen af kappen og længden af mikrotubuli også omvendt - hvis mikrotubuli strækkes af en ekstern kraft, så falder belægningen dannet af tau- eller MAP2-molekyler af. Dette rejser spørgsmålet om, hvilket formål denne følsomhed af det kappe-coatede mikrotubulus netværk over for mekanisk spænding kan tjene i nerve (eller endda muskel) celler under fysiologiske forhold.
En anden interessant egenskab ved tau- og MAP2-proteinkapper er, at de selektivt påvirker passagen af molekylære motorer langs mikrotubuli. Mens dyneinmotorer, der bevæger sig mod cellekernen (retrograd), kan overvinde tau- eller MAP2-kapper, er disse områder en stor hindring for nogle kinesinmotorer, der bevæger sig mod plasmamembranen (anterograd). På mikrotubuli skaber bindingen af de undersøgte MAP'er således områder, hvor godstransport er begrænset til kun transport i én retning, eller passage kun er tilladt til visse typer molekylære motorer. Særlige sektioner af mikrotubuli får således forskellige funktioner, hvilket er vigtigt for nervecellens korrekte funktion. Tau-familiens proteiner ser ud til at rumme mange flere overraskelser. + Udforsk yderligere
Første bevis på mikrotubuli's mekanosensitive adfærd
 Varme artikler
Varme artikler
-
 Er dyr stadig i udvikling?Vi kan aldrig se den dag, elefanter bor i hjem og kører på motorcykler, men det betyder ikke, at de - og andre skabninger - har nået deres evolutionære top. John Lund/Stephanie Roeser/Getty Images Me
Er dyr stadig i udvikling?Vi kan aldrig se den dag, elefanter bor i hjem og kører på motorcykler, men det betyder ikke, at de - og andre skabninger - har nået deres evolutionære top. John Lund/Stephanie Roeser/Getty Images Me -
 Nyt håb for kritisk truet Myanmar snudenæseabeSpædbarn Myanmar eller sort abe med snudenæse. Kredit:Shaohua Dong Otte år efter opdagelsen af en ny primatart i Myanmar, videnskabsmænd har udgivet en ny rapport, der afslører, hvordan det går
Nyt håb for kritisk truet Myanmar snudenæseabeSpædbarn Myanmar eller sort abe med snudenæse. Kredit:Shaohua Dong Otte år efter opdagelsen af en ny primatart i Myanmar, videnskabsmænd har udgivet en ny rapport, der afslører, hvordan det går -
 Stenfremspring påvirker tilstødende jordbund og plantevækst i fine skalaer i karstområderFinskalaeffekt af karstklippefremspring på tilstødende jord- og plantesamfund i Yunnan. Kredit:Shen Youxin Klippefremspring (ROCer), som enten forekommer som udsatte dele af grundfjeldet eller som
Stenfremspring påvirker tilstødende jordbund og plantevækst i fine skalaer i karstområderFinskalaeffekt af karstklippefremspring på tilstødende jord- og plantesamfund i Yunnan. Kredit:Shen Youxin Klippefremspring (ROCer), som enten forekommer som udsatte dele af grundfjeldet eller som -
 Teamet undersøger kønsbestemmelsesmekanismer hos fugleHun-specifikke potentielle processer og veje blev identificeret i kylling primordiale kønsceller (PGCer) afledt af tidlige embryoner. Kredit:Kennosuke Ichikawa, Genome Editing Innovation Center For
Teamet undersøger kønsbestemmelsesmekanismer hos fugleHun-specifikke potentielle processer og veje blev identificeret i kylling primordiale kønsceller (PGCer) afledt af tidlige embryoner. Kredit:Kennosuke Ichikawa, Genome Editing Innovation Center For


