Hvordan et internt kropsur holder rundorme fri for forstoppelse
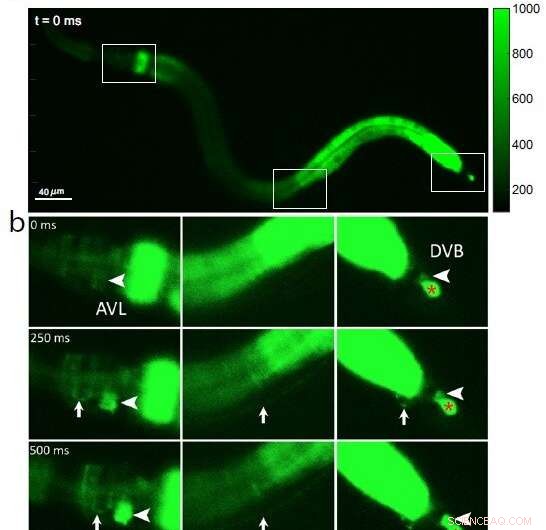
Fig. 1:Calcium-fluorescensbilleder af en hel C. elegans-orm, der viser (a) tre indrammede sektioner af interesse fra hoved til hale (venstre mod højre) på tidspunktet 0 før nervecelleaktivering; (b) en indledende calciumbølge i tarmen efterfølges af aktivering af nervecellelegemet AVL i hovedet (stor pilespids, venstre panel), AVL nervefiber (lille pil, venstre og midterste paneler), præanal nerve-muskelforbindelse (lille pil, højre panel) og nervecellekrop DVB i halen (stor pilespids, højre panel). Som en negativ kontrolreference viser den røde * i højre panel en upåvirket celle, der er irrelevant for afføringscyklussen. Kredit:Jiang, J. et al., Nature Communications (2022). DOI:10.1038/s41467-022-30452-y
Et team ledet af en neuroforsker fra City University of Hong Kong (CityU) har identificeret en nøglemekanisme i et biologisk ur, der sikrer, at rundorme forbliver regelmæssige ved at gøre afføring med jævne mellemrum.
Afføringstrinnet er under tidsstyret kontrol af en nervecelle placeret i ormens hoved. Denne celle affyrer en nerveimpuls, eller et udbrud af elektrisk udladning, hvert 45. sekund eller deromkring. Hver impuls overføres straks langs ormen gennem en nervefiber, der kommer i kontakt med en nervecelle i halen. Denne celle affyrer derefter en impuls med den næsten synkroniserede impuls fra hovednervecellen, der stimulerer de nedre tarmmuskler til at udstøde afføring.
"Den 1 millimeter lange rundorm Caenorhabditis elegans, eller C. elegans, bruges som modelorganisme af livsforskere over hele verden. Når vildtypeorme er i nærværelse af masser af mad, spiser de konstant uden at stoppe, men poop hvert 45. sekund med næsten urlignende præcision. Hvorfor og hvordan orme gør det, har tiltrukket forskere til at studere dets underliggende mekanismer," siger teamets medleder Dr. Liu Qiang, adjunkt i CityU Department of Neuroscience. "Vores resultater løser dette 30-årige mysterium og uddyber vores forståelse af rytmisk adfærdsgenerering, såvel som forbindelserne mellem et dyrs nervesystem og fysiologi."
Forskningen blev i fællesskab overvåget af Dr. Liu Qiang fra CityU og Dr. Louis Tao fra Peking University. Resultaterne blev offentliggjort den 19. maj 2022 i Nature Communications , under titlen "C. elegans enteriske motoriske neuroner affyrer synkroniserede aktionspotentialer, der ligger til grund for afføringsmotorprogrammet."
Tarm-hjerne-kredsløb
C. elegans er velundersøgt inden for neurovidenskab og hjerneforskning, og alle 302 celler i dets nervesystem er blevet identificeret, navngivet og fysisk kortlagt sammen med alle deres nerveforbindelser. De to vigtige nerveceller, der er involveret i at regulere afføringen, er AVL i hovedet og DVB i halen.
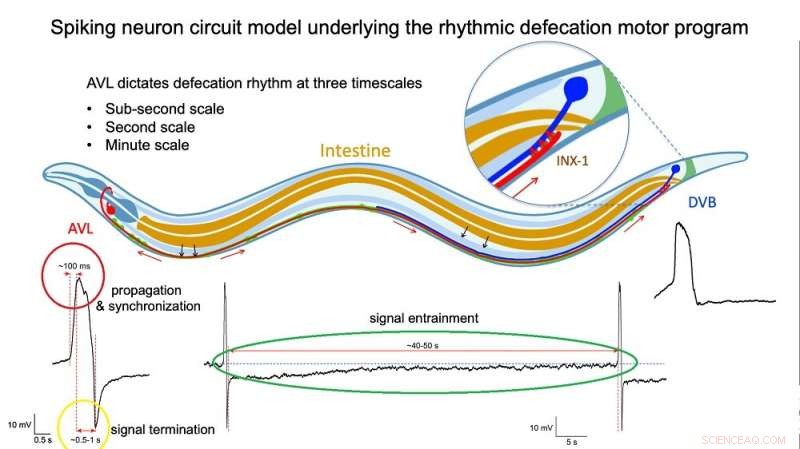
Fig. 2:Illustration af spike-neuronkredsløbsmodel, der ligger til grund for den rytmiske afføringsadfærd. Kredit:Dr. Liu Qiang/ City University of Hong Kong
"Forskere havde vidst, at C. elegans-tarmen genererer periodisk stigning af calcium kaldet calciumbølger i epitelcellerne, som forårsager frigivelsen af tarmens neuropeptider, der stimulerer AVL- og DVB-nerveceller, hvilket fører til afføring. Men de underliggende kommunikationsmekanismer mellem tarmen og hjernen var ukendte. Hvordan de to enteriske neuroner, den ene i ormens hoved, den anden i halen, kommunikerer med hinanden over så lang en afstand, mens de behandler timingsignalet modtaget fra tarmen med bemærkelsesværdig robusthed og nøjagtighed?" siger Dr. Liu. "For første gang har vi vist, at AVL- og DVB-nerveceller producerer alt-eller-ingen spidse impulser eller aktionspotentialer, og denne digitale signalering lader AVL i hovedet udføre øjeblikkelig langdistancekommunikation med DVB i halen for at regulere udvisning af afføring."
Fordi calciumioner skynder sig ind i cellen under hver nerveimpuls, undersøgte forskerne AVL-til-DVB-signalering ved at bruge et specielt mikroskop til at video orme, der var blevet programmeret til at lyse fluorescerende grønt i nærvær af calcium. De observerede først en generel bølge af calcium bevæge sig ned i tarmen. Efter ca. 3 sekunder opdagede de næsten samtidige calciumspidser i AVL og DVB, der varede et halvt sekund og gentog sig ca. en gang hvert 45. sekund (se figur 1).
Kalciumstigningerne i AVL og DVB faldt sammen med hoved-til-hale muskelbevægelser, der fandt sted på næsten samme tidspunkt som afføring. Ud fra disse resultater konkluderer forskerne, at selvom tarmen i sig selv er den generelle afføringspacemaker, styrer synkroniserede AVL- og DVB-impulser den præcise timing og koordinering af hoved-til-hale krops- og tarmbevægelser, der er nødvendige for uddrivningstrinnet.
Multitasking-handlingspotentiale
Direkte målinger af spændingen over membranen af isolerede AVL- og DVB-celler bekræftede de spidse profiler af deres aktionspotentialer. En nærmere undersøgelse viste, at AVL-impulsen er et usædvanligt aktionspotentiale, der består af to spidser tæt på hinanden. The first spike acts as a positive and rapid signal (signal rise in around 100 milliseconds, red circle in Figure 2) that propagates to DVB quickly (in milliseconds) and switches on the sequence of muscle motions leading to a bowel movement. The second spike acts as a negative and slower signal (in seconds, yellow circle in Figure 2) that switches off the sequence to inhibit further bowel movements and thus prevent excessive excretion. Furthermore, each AVL impulse is also followed by a long-lasting negative undershoot phase (in dozens of seconds, green circle in Figure 2) that inhibits DVB misfiring impulses when it is not supposed to.
"The AVL nerve cell in the head plays the most crucial role in regulating the defecation rhythm at multiple time scales," says Dr. Liu. "It not only relays but also modulates the pacemaker signal from the gut by resetting the system during each defecation cycle and preventing nerve misfiring between cycles, so that the body clock is kept robust and accurate."
This study paves the way for further research into gut–brain communication and other body clock systems underlying repetitive animal behaviors. "I have no doubt that fundamental principles of brain function learned from studying worms will be used as a springboard to gain understanding of more complex brains like ours," adds Dr. Liu.
Sidste artikelSådan producerer stressede planter deres egen aspirin
Næste artikelHvordan vandlopper forsvarer sig mod kødædende planter
 Varme artikler
Varme artikler
-
 Hvorfor vil det aldrig fungere at forbyde vandreture til verdens højeste træKredit:Lamiot, CC BY-SA 3.0 , via Wikimedia Commons National Park Service forsøger at bevare verdens højeste træ ved at forbyde vandreture til det. Men denne tilgang vil aldrig helt fungere, da pla
Hvorfor vil det aldrig fungere at forbyde vandreture til verdens højeste træKredit:Lamiot, CC BY-SA 3.0 , via Wikimedia Commons National Park Service forsøger at bevare verdens højeste træ ved at forbyde vandreture til det. Men denne tilgang vil aldrig helt fungere, da pla -
 Ny undersøgelse beskriver, hvordan befrugtning udløser ændringer i tusinder af proteiner i frøæ…Overfladekontraktionsbølger på et frøæg udløses af befrugtning og drives af proteinaktivitet. Kredit:Tessa Montague I mere end et halvt århundrede, undersøgelser af den afrikanske klofrø (Xenopus
Ny undersøgelse beskriver, hvordan befrugtning udløser ændringer i tusinder af proteiner i frøæ…Overfladekontraktionsbølger på et frøæg udløses af befrugtning og drives af proteinaktivitet. Kredit:Tessa Montague I mere end et halvt århundrede, undersøgelser af den afrikanske klofrø (Xenopus -
 Hvad er det næste for ældgamle DNA-studier, efter at Nobelprisen hædrer banebrydende felt inden f…2010-udgravningen i East Gallery of Denisova Cave, hvor den gamle hominin-art kendt som Denisovans blev opdaget. Kredit:Bence Viola. Afdeling for antropologi, University of Toronto, CC BY-ND For fø
Hvad er det næste for ældgamle DNA-studier, efter at Nobelprisen hædrer banebrydende felt inden f…2010-udgravningen i East Gallery of Denisova Cave, hvor den gamle hominin-art kendt som Denisovans blev opdaget. Kredit:Bence Viola. Afdeling for antropologi, University of Toronto, CC BY-ND For fø -
 Rødbugede lemurer opretholder tarmens sundhed ved at røre og klemme hinandenRødbuget lemur i træerne på Madagaskar. Kredit:Avery Lane, Helsinki Universitet Forskere har fundet en direkte sammenhæng mellem fysisk kontakt og tarmbakterier i rødbugede lemurer. Sandsynligvis
Rødbugede lemurer opretholder tarmens sundhed ved at røre og klemme hinandenRødbuget lemur i træerne på Madagaskar. Kredit:Avery Lane, Helsinki Universitet Forskere har fundet en direkte sammenhæng mellem fysisk kontakt og tarmbakterier i rødbugede lemurer. Sandsynligvis
- Det bedste bevis nogensinde for eksistensen af nogen
- Hvordan er en skrue som et skråt plan?
- Undersøgelse af porerne i membranvesikler
- Definition af øjenvæggen af en orkan
- Fransk domstol beordrer Google til at fjerne misbrugsklausuler
- Havniveaustigningen kræver ekstra forvaltning for at vedligeholde strandenge


