Hvordan kimære, dråbedannende proteiner kan bidrage til kræft
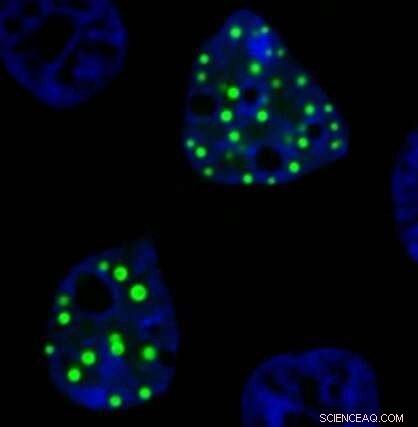
Et mikroskopbillede viser onkofusionsproteinet FUS-DDIT3, der danner ektopiske dråber inde i laboratorie-dyrkede levende celler. Disse proteindråber fremstår som en lysegrøn klat, da de er mærket med et grønt fluorescerende protein. Kredit:Richoo B. Davis
I optakten til kræft kan genetiske mutationer nogle gange føre til dannelsen af kimære proteiner lavet af dele af to forskellige proteiner, som normalt er adskilte.
Et nyt gennemgangspapir undersøger den seneste videnskab om en bestemt klasse af disse kræftforbundne "onkofusionsproteiner", med fokus på de onkofusionsproteiner, der kan danne væskelignende dråber kaldet "ektopiske kondensater" i celler.
Artiklen blev offentliggjort den 25. april i Trends in Cell Biology af University at Buffalo forskere Richoo B. Davis, Mahdi Muhammad Moosa og Priya R. Banerjee, alle i Institut for Fysik i UB College of Arts and Sciences. Banerjee, Ph.D., er assisterende professor i fysik, og Davis, Ph.D., og Moosa, Ph.D., er postdoc-medarbejdere i Banerjee Lab.
I laboratorieforsøg opstår ektopiske kondensater, når en del af et protein, der normalt danner dråber, fusioneres med en del af et andet protein, der normalt findes et andet sted i en celle. Det resulterende kimære protein bevarer nogle funktioner fra begge de originale proteiner og er i stand til at danne dråber på det "forkerte" sted inde i cellerne, siger Moosa.
Proteindråber, også kendt som "membranløse organeller", kan tjene som hubs for biokemisk aktivitet, så malplacerede dråber med afvigende funktioner er interessante at undersøge, siger forskerne.
"Et vigtigt publikum for vores anmeldelse er kræftforskere," siger Moosa. "Biofysikere, der studerer biomolekylære kondensater, kender måske allerede disse begreber, men vi ønskede at nå ud og dele denne indsigt med kræftbiologiske forskere, som arbejder direkte med patientprøver."
Davis bemærker, at ektopiske kondensater kunne tilbyde et attraktivt mål for kræftbehandling, men at der er behov for mere forskning for bedre at forstå, hvordan disse kimære proteiner fungerer i deres naturlige tilstand, og hvordan de kan omkoble gentransskription, der fører til kræftudvikling:"Cellen er en meget komplekst system,« siger han. "Vi har brug for bedre værktøjer til at studere proteinkondensater i deres oprindelige forhold, og vores fremtidige undersøgelser vil være fokuseret på at løse dette."
I oversigtsartiklen opsummerer forfatterne nye resultater fra flere nyligt publicerede værker fra forskellige forskningsgrupper, herunder et 2021-studie, de gennemførte sammen med Taranpreet Kaur, en nylig UB fysik Ph.D. kandidat.
Det tidligere papir, der vises i et specialnummer af tidsskriftet Protein Science om "Biophysics of Biomolecular Condensates," fokuseret på et FET-familie onkofusionsprotein og fik titlen, "FUS oncofusion protein condensates rekruttere mSWI/SNF kromatin remodeler via heterotypiske interaktioner mellem prion-lignende domæner." Holdet viste, hvordan disse ektopiske proteinkondensater kan rekruttere vigtige molekylære maskiner til at ændre balancen i genregulering.
"Opdagelsen af proteinfaseseparation har ændret vores syn på, hvordan celler organiserer deres indre rum," siger Banerjee. "Efterhånden som mere og mere forskning dukker op inden for dette spændende felt, lærer vi om proteindråbernes rolle i vigtige biologiske processer såsom genregulering og deres roller i dødelige menneskelige sygdomme. Baseret på de nye data fra forskellige laboratorier har vi mistanke om, at en undergruppe af cancer-bundne fusionsproteiner kan danne nye typer kondensater, som normale celler ikke besidder."
"Undersøgelsen af naturligt forekommende fusionsproteiner og deres kondensater med nye biologiske funktioner er ikke kun vigtige ud fra et kræftbiologisk perspektiv, men også ud fra et proteinteknologisk synspunkt, da det at lære, hvordan disse fusionsproteiner virker, vil give nye muligheder for at skabe kunstige proteiner med nye applikationer i biomedicinske videnskaber," tilføjer Banerjee.
 Varme artikler
Varme artikler
-
 Heling af brændte poter med fiskeskindJamie Peyton påfører tilapia-skind på bjergløveungens fod. Kredit:Karin Higgins/UC Davis I kølvandet på massive skovbrande, der brændte gennem Sonoma- og Napa-områderne sidste efterår, Deana Cliff
Heling af brændte poter med fiskeskindJamie Peyton påfører tilapia-skind på bjergløveungens fod. Kredit:Karin Higgins/UC Davis I kølvandet på massive skovbrande, der brændte gennem Sonoma- og Napa-områderne sidste efterår, Deana Cliff -
 Videnskabsprojekter: Rygning og dens virkninger på lungerneRygning har en række alvorlige syge effekter på helbredet. Selvom rygning påvirker både luftvejssystemet og det kardiovaskulære system, kan studerende gennemføre en række videnskabelige projekter for
Videnskabsprojekter: Rygning og dens virkninger på lungerneRygning har en række alvorlige syge effekter på helbredet. Selvom rygning påvirker både luftvejssystemet og det kardiovaskulære system, kan studerende gennemføre en række videnskabelige projekter for -
 Kønsroller i oldtidenFigur 1:Fluorescens af dsx1 -reporterstammen. Ni dage gamle fuldt modne dafniider blev observeret under lyst felt (øverste række), GFP -filter (midterste række), og mCherry-filter (nederste række). Ub
Kønsroller i oldtidenFigur 1:Fluorescens af dsx1 -reporterstammen. Ni dage gamle fuldt modne dafniider blev observeret under lyst felt (øverste række), GFP -filter (midterste række), og mCherry-filter (nederste række). Ub -
 Sådan beregnes den primære produktivitetBiologer bruger primær produktivitet eller primær produktion til at bestemme, hvor effektivt planter omdanner kuldioxid, vand og lysenergi til glukose og ilt gennem fotosynteseprocessen, ifølge den ca
Sådan beregnes den primære produktivitetBiologer bruger primær produktivitet eller primær produktion til at bestemme, hvor effektivt planter omdanner kuldioxid, vand og lysenergi til glukose og ilt gennem fotosynteseprocessen, ifølge den ca
- Hvordan man laver blyantleder
- Elektronstrålemikroskop skriver direkte funktioner på nanoskala i væske med metalblæk
- Israelsk spywarefirma kan mine data fra sociale medier
- Hvordan fungerer bortskaffelse af atomaffald?
- Forskere afslører fordeling af mørkt stof omkring galakser for 12 milliarder år siden
- Milliarder af nanoreaktorer informerer om materialedesign


