Er ægceller i aldrende primater beskyttet mod mutationer?
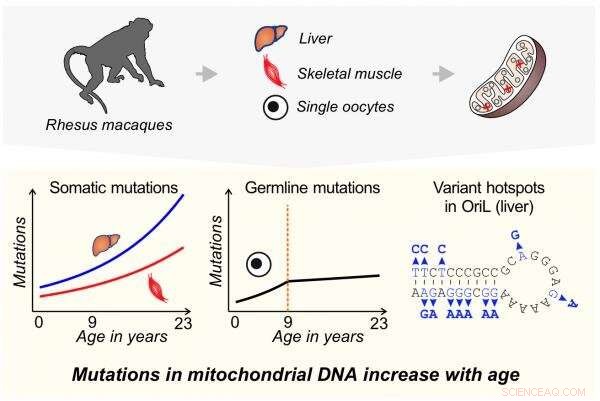
En ny undersøgelse viser, at mutationsfrekvenser i mitokondrie-DNA er lavere og stiger mindre med alderen i ægcellernes forstadier end i cellerne i andet væv hos en primat. Mitokondrielt DNA blev sekventeret i lever, skeletmuskulatur og enkelte oocytprøver fra 1- til 23-årige rhesus makakaber. Nye mutationer steg med alderen hurtigst i leveren og langsomst i oocytter. Mutationshyppigheden i oocytter steg kun indtil 9 års alderen. Lysstrengens replikationsorigin (OriL), den region, der er ansvarlig for at kopiere de mitokondrielle genomer, blev fundet at være et hotspot for mutationsakkumulering med aldring i leveren. Kredit:Barbara Arbeithuber
Nye mutationer forekommer med stigende hastigheder i mitokondrielle genomer af udviklende ægceller i aldrende rhesus-aber, men stigningerne ser ud til at plateau i en vis alder og er ikke så store som dem, der ses i ikke-reproduktive celler, såsom muskler og lever. En ny undersøgelse, der anvender utrolig nøjagtig DNA-sekventeringsmetodologi, tyder på, at der kan være en beskyttelsesmekanisme, der holder mutationshastigheden i reproduktive celler relativt lavere sammenlignet med andre væv hos primater, en kendsgerning, der kan være relateret til primatens – og dermed menneskets – tilbøjelighed til at reproducere i senere aldre.
"På grund af sygdommene hos mennesker forårsaget af mutationer i mitokondrie-genomet og tendensen i moderne menneskelige samfund til at få børn i ældre aldre, er det vigtigt at forstå, hvordan mutationer akkumuleres med alderen," siger Kateryna Makova, formand for Life i Verne M. Willaman. Sciences at Penn State og en leder af forskerholdet.
"Mit laboratorium har i lang tid været interesseret i at studere mutationer - herunder mutationer i mitokondrielt DNA - i lang tid. Vi er også interesserede i evolution, så vi ville se, hvordan mutationer i mitokondrielt DNA akkumuleres i reproduktive celler, fordi disse mutationer kan overføres til næste generation." Et papir, der beskriver undersøgelsen, ledet af forskere ved Penn State, vises online i ugen den 4. april 2022 i The Proceedings of the National Academy of Sciences .
Mitokondrier er cellulære organeller - ofte kaldet cellens kraftcenter på grund af deres rolle i energiproduktionen - som har et eget genom adskilt fra cellens "kernegenom", som er placeret i kernen og er det, vi ofte tænker på som "genomet". Mutationer i mitokondrie-DNA bidrager til flere menneskelige sygdomme, men at studere nye mutationer er udfordrende, fordi ægte mutationer er svære at skelne fra sekventeringsfejl, som forekommer med en højere hastighed sammenlignet med mutationshastigheden for de fleste sekventeringsteknologier.
"For at overvinde denne vanskelighed brugte vi en metode kaldet 'duplex sekventering'," sagde Barbara Arbeithuber, en postdoc-forsker ved Penn State på tidspunktet for forskningen, som nu er forskningsgruppeleder ved Johannes Kepler University Linz i Østrig. "DNA er sammensat af to komplementære strenge, men de fleste sekventeringsteknikker ser kun på sekvenserne fra en af strengene ad gangen. I duplex-sekventering bygger vi konsensussekvenser for hver streng individuelt og sammenligner derefter de to. Fejl er yderst usandsynlige, at ske på samme sted på begge strenge, så når vi ser ændringer på begge strenge, kan vi være sikre på, at det repræsenterer en ægte mutation."
Holdet sekventerede mitokondrielle genom fra muskelceller, leverceller og oocytter - forløberceller i æggestokken, der kan blive til ægceller - i rhesus makakaber, der varierede i alderen fra 1 til 23 år. Denne aldersgruppe dækker næsten hele abernes reproduktive levetid. Væv til undersøgelsen blev indsamlet opportunistisk i løbet af flere år fra primatforskningscentre, når dyr døde af naturlige årsager eller blev ofret på grund af sygdomme, der ikke var relateret til reproduktion. Oocytter, og ikke sædceller, blev brugt, fordi mitokondrier udelukkende nedarves gennem moderens linje.
Samlet set så forskerne en stigning i mutationsfrekvensen i alle de testede væv, efterhånden som makakerne ældes. Leverceller oplevede den mest dramatiske ændring med en 3,5-fold stigning i mutationsfrekvensen over cirka 20 år. Mutationshyppigheden i muskler steg 2,8 gange over det samme tidsrum. The mutation frequency in oocytes increased by 2.5-fold up to age nine, at which point it remained steady.
"From a reproductive biology perspective, oocytes are really interesting and special cells," said Francisco Diaz, associate professor of reproductive biology at Penn State. "They are generated prior to birth and sit in the ovary for years and years and years, and then a few of them are activated each reproductive cycle. So, you would expect them to accumulate a lot of mutations over that time, but instead we see that they accumulate mutations for a while and then they do not. This seems to indicate that the germ line—reproductive cells like egg and sperm—may be more resilient than we thought."
In addition to changes in the rate of mutations over time, the research team also identified variation in mutation frequency across the mitochondrial genome, including several hotspots where mutations occurred much more frequently than you would expect by chance that varied by tissue. One of the hotspots was located in the region responsible for copying of mitochondrial genomes.
"Although it is very challenging to perform a study like this in humans, using a primate model species gives us a close approximation," said Makova. "Our results suggest that primate oocytes might have a mechanism to protect or repair their mitochondrial DNA, an adaptation that helps to allow later reproduction. The precise mechanism leading to the plateau in mutation frequency in oocytes remains enigmatic, but it might act at the level of elimination of defective mitochondria or oocytes."
 Varme artikler
Varme artikler
-
 Sådan fungerede Albert Einsteins hjerneAlbert Einstein, 13 måneder før hans død. Se flere hjernebilleder. American Stock/Hulton Archive/Getty Images I hans sidste leveår, Albert Einstein vidste, at han var syg og nægtede operationer, der
Sådan fungerede Albert Einsteins hjerneAlbert Einstein, 13 måneder før hans død. Se flere hjernebilleder. American Stock/Hulton Archive/Getty Images I hans sidste leveår, Albert Einstein vidste, at han var syg og nægtede operationer, der -
 Ny algoritme genkender tydelige delfinklik i undervandsoptagelserTredimensionel gengivelse af Rissos delfin ekkolokalisering klikspektre optaget i Den Mexicanske Golf, aggregeret af en uovervåget indlæringsalgoritme. Kredit:Kaitlin Frasier Forskere har udviklet
Ny algoritme genkender tydelige delfinklik i undervandsoptagelserTredimensionel gengivelse af Rissos delfin ekkolokalisering klikspektre optaget i Den Mexicanske Golf, aggregeret af en uovervåget indlæringsalgoritme. Kredit:Kaitlin Frasier Forskere har udviklet -
 Nyt RNA-baseret værktøj kan belyse hjernekredsløb, redigere specifikke cellerAt mærke og belyse kun de hæmmende bremse-celler (grønne) i menneskets hjernevæv er blot en af mange ting, det nye værktøj fra Duke University, CellREADR, kan gøre. Kredit:Derek Southwell, Duke Univ
Nyt RNA-baseret værktøj kan belyse hjernekredsløb, redigere specifikke cellerAt mærke og belyse kun de hæmmende bremse-celler (grønne) i menneskets hjernevæv er blot en af mange ting, det nye værktøj fra Duke University, CellREADR, kan gøre. Kredit:Derek Southwell, Duke Univ -
 Den skrumpende elg på Isle RoyaleForskerne målte længden, bredde og højde af elgkranier for at studere klimaændringernes indvirkning på den ikoniske Northwoods-art. Holdet målte 662 elgkranier og observerede et fald på 16 procent i s
Den skrumpende elg på Isle RoyaleForskerne målte længden, bredde og højde af elgkranier for at studere klimaændringernes indvirkning på den ikoniske Northwoods-art. Holdet målte 662 elgkranier og observerede et fald på 16 procent i s
- Klimaændringer giver gamle træer en vækstspurt
- Hvordan forskere diagnosticerede et 200 millioner år gammelt inficeret rovdyrbid
- For billigt til at lægge mærke til vand er ved at være slut, og vandforsyninger skal advare forbr…
- Ultrahøje præcisionspolymerer
- Europas egen navigator Galileo går live (opdatering)
- Sådan forbedres klimamodellering og forudsigelse


