Sådan styrer stresshormoner bakterier i deres vært
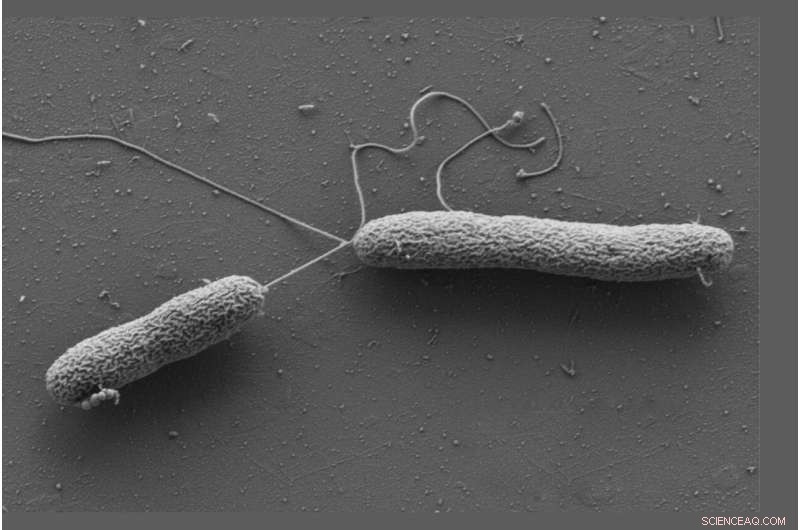
Celler af Vibrio campbellii bevæger sig ved hjælp af lange flageller. Kredit:Wanner/Jung, LMU
Hos mennesker og dyr er katekolaminer som epinephrin, noradrenalin og dopamin almindelige stresshormoner. Stress kan øge kroppens modtagelighed for bakterielle infektioner. I laboratoriet stimulerer stresshormoner væksten af forskellige patogener. Dette var allerede blevet observeret i Salmonella (Salmonella enterica serovar Typhimurium) og andre tarmbakterier, Escherichia coli og det forårsagende middel til kolera, Vibrio cholerae. Desuden gør adrenalin og noradrenalin det nemmere for bakterier at inficere kroppens celler. Og disse hormoner påvirker også biosyntesen af virulensfaktorer, som gør det muligt for patogener at klæbe til, trænge ind og ødelægge celler.
"Vi havde derfor mistanke om, at nogle bakterier bruger sådanne hormoner som signaler til at genkende det eukaryote værtsmiljø," siger LMU-mikrobiolog professor Kirsten Jung. "Men det molekylære grundlag var ikke kendt." Sammen med professor Stephan A. Sieber fra det tekniske universitet i München (TUM) og andre forskere har Jung nu identificeret bindingsstedet for adrenalin og adrenalinderivatet phenylephrin i bakterien Vibrio campbellii. Som holdet rapporterer i PNAS , er målet for begge molekyler proteinet CheW. "Den biologiske betydning af mekanismen er, at bakterier for eksempel erkender, at de ikke længere er i havvand, men i en værts tarm," forklarer Jung.
Undersøgelser med modelorganismen V. campbellii
"Vi ønskede at vide, hvordan bakterier genkender katekolaminer som signalmolekyler," siger LMU-forskeren. "Hvilke receptorer styrer denne proces?" Hendes eksperimenter bestod af flere individuelle trin.
Til undersøgelsen udviklede Sieber en metode til kemisk at modificere epinephrin og phenylephrin, så forskerne direkte kunne isolere komplekser fra katekolaminerne og de bundne bakterieproteiner. En forudsætning for forsøgene var, at de nye forbindelser ikke ville have nogen biologiske egenskaber, som de umodificerede molekyler ikke havde. Jungs gruppe udførte laboratorieforsøg for at vise, at dette var tilfældet. Adrenalin binder jern, hvorimod adrenalinderivatet phenylephrin ikke gør. Med deres valg af forbindelser ønskede forskerne at udelukke effekter, der opstår, når bakterierne har en bedre forsyning af jern.
Jung og Sieber arbejdede med Vibrio campbellii som en modelorganisme. Den marine bakterie inficerer fisk, rejer, blæksprutter og mange andre marine hvirvelløse dyr. De tilføjede Vibrio campbellii til de kemisk modificerede katekolaminer og lyserede cellerne. Dernæst ekstraherede de fra lysatet alle proteiner, som et molekyle havde bundet til, og karakteriserede dem ved hjælp af proteomanalyse. Dette resulterede i en særlig berigelse af det opløselige kemotakseprotein CheW.
Efterfølgende isolerede Jungs gruppe CheW-proteinet direkte fra bakterier, rensede det og målte dets bindingsaffinitet til katekolaminer. I processen opdagede forskerne noget overraskende:Hormonerne binder sig ikke til selve kemoreceptorerne, som oprindeligt forventet, men til koblingsproteinet CheW, som er placeret mellem receptorer og en signaltransduktionskaskade. Hele dette stimulusopfattelsessystem styrer bakteriens bevægelse i en kemisk gradient.
"Vores undersøgelse giver ny indsigt i bakteriernes kommunikation med deres vært," opsummerer Jung. "Vi var i stand til at vise, at bakteriers svømmeadfærd modificeres af værtshormoner, som styres af CheW." Motilitet, og især rettet motilitet, er afgørende vigtig for værtskolonisering, da bakterier bevidst søger at kolonisere en organisme og erobre alle nicher. I næste trin vil Jung nu finde ud af, om samme mekanisme kan påvises i andre bakterier.
 Varme artikler
Varme artikler
-
 Hunde er mere udtryksfulde, når nogen kiggerKredit:CC0 Public Domain Hunde producerer flere ansigtsudtryk, når mennesker ser på dem, ifølge ny forskning fra University of Portsmouth. Forskere ved universitetets hundekognitionscenter er de
Hunde er mere udtryksfulde, når nogen kiggerKredit:CC0 Public Domain Hunde producerer flere ansigtsudtryk, når mennesker ser på dem, ifølge ny forskning fra University of Portsmouth. Forskere ved universitetets hundekognitionscenter er de -
 Redet Irrawaddy delfinkalv dør trods ugers plejeDen frivillige Tosapol Prayoonsuk fodrer en babydelfin med kælenavnet Paradon med mælk i Marine and Coastal Resources Research and Development Center i Rayong-provinsen i det østlige Thailand, fredag
Redet Irrawaddy delfinkalv dør trods ugers plejeDen frivillige Tosapol Prayoonsuk fodrer en babydelfin med kælenavnet Paradon med mælk i Marine and Coastal Resources Research and Development Center i Rayong-provinsen i det østlige Thailand, fredag -
 En dødelig sygdom har drevet syv australske frøarter til udryddelse. Men denne truede frø kæmper…Kredit:Matthijs Hollanders, Forfatter leveret Frøer er blandt verdens mest udsatte dyr, og en stor del af skylden ligger hos en dødelig frøsygdom kaldet amfibie-chytridsvampen. Chytrid-svampen har
En dødelig sygdom har drevet syv australske frøarter til udryddelse. Men denne truede frø kæmper…Kredit:Matthijs Hollanders, Forfatter leveret Frøer er blandt verdens mest udsatte dyr, og en stor del af skylden ligger hos en dødelig frøsygdom kaldet amfibie-chytridsvampen. Chytrid-svampen har -
 Hvad er funktionerne ved glideskinne og dækglas?Mikroskoper gør det muligt for forskere og studerende at studere cellestrukturer i plante- og dyreorganismer. Den krystallinske struktur af mineraler og indholdet i en dråbe damvand kan også observere
Hvad er funktionerne ved glideskinne og dækglas?Mikroskoper gør det muligt for forskere og studerende at studere cellestrukturer i plante- og dyreorganismer. Den krystallinske struktur af mineraler og indholdet i en dråbe damvand kan også observere
- Australien bør lære af globalt brintfokus, siger rapporten
- Hvordan man identificerer rødder i Ontario, Canada
- Hvordan kommer vand ind i jordens atmosfære?
- Med HUMANS-projektet, et budskab om, at plads er til alle
- Klud ansigtsmasker, der kan desinficeres af sollys
- Monsterplanetopdagelse udfordrer dannelsesteori


