Hvordan fysik og biologi arbejder sammen for at udforske livets mekanismer
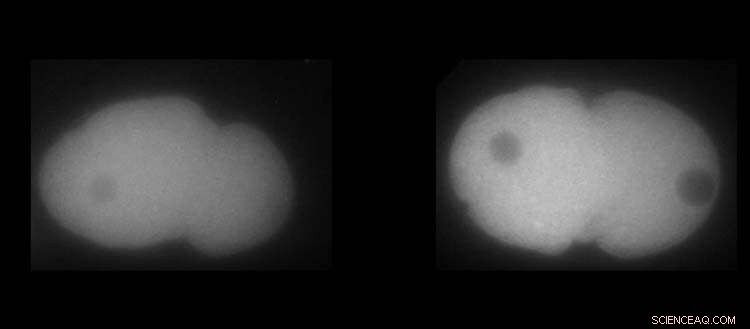
Til venstre, MEX-5 protein. Til højre, PLK-1 protein i C. elegans embryoner. Hvid viser den højere eller lavere tilstedeværelse af proteinerne. Kredit:UNIGE / Laboratoire Monica Gotta
Hver af vores celler indeholder omkring 40 millioner proteiner, der tilsammen udfører alle de opgaver, cellen skal bruge for at overleve. For en jævn handling skal de rigtige proteiner koncentreres i bestemte mængder, på et bestemt tidspunkt og på et bestemt sted. Men at etablere en så delikat fordeling kræver en ekstremt præcis proces, der sker ved små rumlige opløsninger, som standard cellebiologiske værktøjer ofte ikke er i stand til at opdage. For at forstå, hvordan denne mekanisme virker, udviklede forskere fra Universitetet i Genève (UNIGE) en ny tilgang, der kombinerer genetik og cellebiologiske eksperimenter med fysisk modellering. Ved hjælp af specifikke algoritmer simulerede de dannelsen af proteingradienter i 3D og gennem tiden og var i stand til at forklare disse komplekse mekanismer. Desuden kan deres innovative model tilpasses til andre biologiske systemer for at undersøge proteindynamik. Disse resultater kan læses i Proceedings of the National Academy of Sciences .
Som en dråbe blæk i et glas vand kan proteiner diffundere og fordele sig jævnt i hele cellen. Til en del opgaver skal proteiner dog danne gradienter. "Proteingradienter, som opstår fra den ujævne fordeling af proteiner i specifikke cellulære områder, er centrale for mange cellulære og organismers funktioner," forklarer Monica Gotta, professor ved Institut for Cellefysiologi og Metabolisme og i Translational Research Center i Onco- hæmatologi (CRTOH) ved UNIGE Det Medicinske Fakultet, som ledede dette arbejde. "For eksempel er proteingradienter vigtige for celledifferentiering, den proces, hvorved de forskellige celletyper, der udgør en kompleks organisme, dukker op fra en unik celle, det befrugtede æg."
En brug af tilfældighed
PLK-1-proteinet, en nøgleregulator for celledeling, er kendt for at være mere koncentreret på den forreste side af embryonet. Men hvordan kan denne mekanisme sættes på plads, og hvad ville konsekvensen være, hvis den mindste detalje gik galt? Da biologiens sædvanlige redskaber ikke var tilstrækkelige til at besvare dette spørgsmål, var Monica Gotta glad for at byde velkommen til sit hold en fysiker, Sofia Barbieri, post-doc forsker ved Institut for Cellefysiologi og Metabolisme ved UNIGE Det Medicinske Fakultet.
"Jeg kompilerede alt det kendte om denne biologiske proces og nye hypoteser om mekanismerne og udviklede en statistisk model for proteingradientdannelse baseret på probabilistisk matematik," forklarer Sofia Barbieri. "Jeg tyede til specifikke beregningsalgoritmer, kaldet Monte Carlo-simuleringer, opkaldt efter den berømte spilleby." Disse algoritmer bruges til at modellere fænomener med et højt niveau af kompleksitet, såsom finans, handel eller partikelfysik.
Holdet var i stand til at simulere proteingradienter, ikke kun i 3D, men også gennem tiden. En sådan model krævede dog flere iterationer mellem parameteroptimering og sammenligning med biologiske data. Forskerne byggede en første version af modellen, der inkorporerede alle kendte fysiske og biologiske elementer i systemet, og introducerede derefter specifikke parametre, der er nødvendige for at teste flere hypoteser vedrørende de ukendte variable. De simulerede mulige fysiske og biologiske resultater, der ved beregningen reproducerede proteindynamikken og gradientetableringen i cellen, og testede dem i det virkelige liv med in vivo eksperimenter ved hjælp af embryoner fra en lille orm, C. elegans nematode.
Intrikate proteininteraktioner på spil
Takket være det kontinuerlige samspil mellem modellering og cellebiologi var UNIGE-forskerne i stand til at bestemme, hvordan PLK-1-gradienten blev etableret og vedligeholdt over tid. Faktisk skal PLK-1 dynamisk binde til og fjerne fra MEX-5, et andet protein, der er afgørende for udviklingen i C. elegans-embryoet, for at modvirke dets naturlige tendens til at diffundere homogent i cellen. MEX-5 har faktisk evnen til at ændre dens diffusivitet afhængigt af dens position i cellen og til at interagere med andre proteiner, hvilket er afgørende for at berige PLK-1, hvor det er nødvendigt. "Men ganske overraskende er MEX-5 ikke så effektiv til sin opgave, da en stor mængde PLK-1 ikke er bundet til MEX-5," påpeger Sofia Barbieri.
Denne undersøgelse giver en unik kvantitativ model til at forstå dynamiske interaktioner mellem proteiner og kan tilpasses til andre celler eller proteiner, for hvilke de komplekse mekanismer ikke kan testes med sædvanlige cellebiologiske eksperimenter. "Vores arbejde viser, at tværfaglige samarbejder er vigtigere og vigtigere for at komme videre i forskningen," slutter Monica Gotta.
 Varme artikler
Varme artikler
-
 Forskere og landmænd arbejder sammen om at udrydde afrikansk kærlighedsgræsLektor Jennifer Firn på området. Kredit:Queensland University of Technology Et partnerskab mellem QUT, NSW-regeringen og landmænd kan føre til en eventuel udryddelse af det meget invasive afrikans
Forskere og landmænd arbejder sammen om at udrydde afrikansk kærlighedsgræsLektor Jennifer Firn på området. Kredit:Queensland University of Technology Et partnerskab mellem QUT, NSW-regeringen og landmænd kan føre til en eventuel udryddelse af det meget invasive afrikans -
 Hvad udgør et sind? Forsker udfordrer opfattelser af sansning med de mindste skabningerKredit:Jon Sullivan/Wikimedia Commons I begyndelsen af min forskerkarriere for omkring 15 år siden, ville ethvert forslag om, at en bi eller ethvert hvirvelløst dyr havde sit eget sind, eller at
Hvad udgør et sind? Forsker udfordrer opfattelser af sansning med de mindste skabningerKredit:Jon Sullivan/Wikimedia Commons I begyndelsen af min forskerkarriere for omkring 15 år siden, ville ethvert forslag om, at en bi eller ethvert hvirvelløst dyr havde sit eget sind, eller at -
 Hvordan gårde kunne hjælpe med at forsvare jordens eget mikrobiomKredit:Paul Mocan/Unsplash Der skal træffes foranstaltninger for at bevare, genoprette og håndtere mangfoldigheden af mikrober, der lever i jordmiljøer for at forhindre deres udryddelse, ifølge e
Hvordan gårde kunne hjælpe med at forsvare jordens eget mikrobiomKredit:Paul Mocan/Unsplash Der skal træffes foranstaltninger for at bevare, genoprette og håndtere mangfoldigheden af mikrober, der lever i jordmiljøer for at forhindre deres udryddelse, ifølge e -
 Diversitet af store dyr spiller en vigtig rolle i kulstofkredsløbetMedlemmer af jordprøvetagningsholdene, består af oprindelige Wapishana-folk. Kredit:Jose Fragoso Træer i tropiske skove er velkendte for at fjerne kuldioxid fra luften og lagre den potente drivhus
Diversitet af store dyr spiller en vigtig rolle i kulstofkredsløbetMedlemmer af jordprøvetagningsholdene, består af oprindelige Wapishana-folk. Kredit:Jose Fragoso Træer i tropiske skove er velkendte for at fjerne kuldioxid fra luften og lagre den potente drivhus
- Biologer tager fat på den globale udryddelseskrise
- Fysisk aktivitet kan være med til at lukke velstandskløften i skolegang
- Scanning af tunnelmikroskopi afslører uventet optisk fononeffekt
- Er madbaseret plast en god idé?
- I fællesskab, miljøinteressenter er lige så kloge som videnskabelige eksperter
- En lillebitte, tidsbegrænset behandling


