Hvordan et tosidet molekyle kan dæmpe problematiske gener
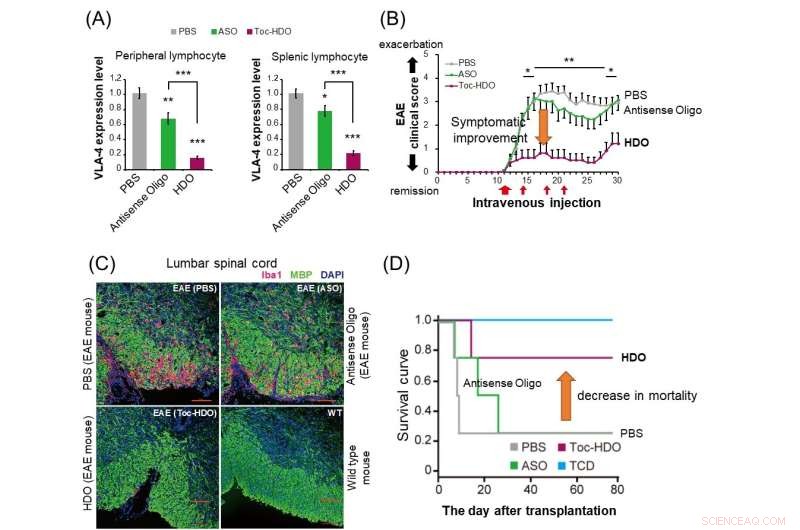
(A) Hos normale mus undertrykker administration af HDO (rød søjle) mere drastisk α4β1-integrin-genekspression i perifere og miltlymfocytter sammenlignet med antisense-oligonukleotid (grøn søjle). (B) I eksperimentel autoimmun encephalomyelitis (EAE) mus har administration af HDO rettet mod α4β1 integrin efter symptomstart vist forbedring i klinisk score. (C) Administration af HDO rettet mod α4β1-integrin før starten af EAE-mus resulterer i reduceret Iba1-positiv inflammatorisk celleinfiltration (rød) og forbedret demyelinisering (grøn) i Lumbal rygmarv.(D) I musemodellen af graft-versus -host-disease (GVHD), transplantation af milt-afledte T-celler sammen med knoglemarvsceller efter behandling med HDO målrettet α4β1-integrin forbedrede overlevelseskurven. TCD:Transplanterede knoglemarvsceller uden milt-afledte T-celler. Kredit:Institut for Neurologi og Neurologisk Videnskab, TMDU
T- og B-lymfocytter, som er en del af en gruppe af immunceller, der almindeligvis kaldes hvide blodlegemer, arbejder sammen for at eliminere fremmede angribere i kroppen, såsom vira. Visse sygdomme kan dog opstå, når T- og B-celler aktiveres på uhensigtsmæssige tidspunkter, herunder autoimmune lidelser og forskellige kræftformer. I en nylig artikel offentliggjort i Nature Communications , beskriver et hold ledet af forskere ved Tokyo Medical and Dental University (TMDU) en teknologi kaldet et heteroduplex oligonukleotid (HDO), som de udviklede til at levere til lymfocytter og regulere deres funktioner.
Genekspression er roden til at kontrollere cellulær aktivitet. Sygdom kan opstå, når visse gener enten slås forkert fra eller udtrykkes ukontrolleret. Derfor har forskere haft til formål at udvikle terapeutiske metoder til at genoprette genekspressionsniveauer til deres sunde tilstand, ideelt set kun i de unormale celler. En sådan modalitet er at levere specifikt konstruerede DNA- eller RNA-molekyler, der kan lokalisere de fejludtrykte genmeddelelser og dirigere cellen til at sænke dem tilbage til normale niveauer. Den sværeste del af dette er dog at sikre, at de terapeutiske molekyler effektivt kan nå deres rette destination uden at blive nedbrudt af cellen.
"Vores team designede et DNA/RNA-hybridmolekyle kaldet en HDO," siger hovedforfatter af undersøgelsen Masaki Ohyagi. "Den specifikke sekvens af HDO kan ændres for at målrette mod et bestemt gen af interesse, mens dets rygrad gør det stabilt i celler."
En vigtig del af teamets HDO-design er tilføjelsen af et molekyle kaldet α-tocopherol, som er afgørende for dets korrekte levering. Fordi α-tocopherol er essentielt for korrekte lymfocytiske immunresponser, tillader tilføjelse af dette, at HDO kan leveres i perifert blod og ledes til lymfocytter. Holdet designede HDO'er til adskillige musegener og injicerede dem derefter intravenøst i laboratoriemus.
"Vi fandt ud af, at vores HDO-teknologi var i stand til specifikt at dæmpe disse gener i muselymfocytter mere robust og stabilt, og også med mindre toksicitet, end andre tidligere versioner af denne metode," siger Takanori Yokota, seniorforfatter til artiklen. "Vores undersøgelser viste også, at HDO'erne kommer ind i disse celler gennem en proces kaldet endocytose."
Efter at have fundet ud af, at deres teknologi var effektiv til gendæmpning, undersøgte TMDU-teamet, om det kunne være nyttigt som sygdomsbehandling. De designede en HDO rettet mod et gen kaldet Itga4, som er centralt for patogenesen af eksperimentel autoimmun encephalomyelitis (EAE), en musemodel for multipel sklerose (MS).
"Intravenøs injektion af disse mus med en Itga4-målrettet HDO forsinkede starten og forbedrede EAE-symptomer og reducerede både inflammatorisk celleinfiltration og rygmarvsdemyelinisering," forklarer Ohyagi.
Dette arbejde demonstrerer HDO-teknologiens kraftfulde gendæmpende virkninger såvel som dens overlegne leveringsevner i forhold til andre lignende metoder. Mest signifikant var den Itga4-specifikke HDO i stand til at forbedre resultaterne i en MS musemodel, hvilket tyder på, at det kan være nyttigt som et nyt terapeutisk middel, der kunne udvikles til humane immunmedierede sygdomme.
 Varme artikler
Varme artikler
-
 Sover ulve som hunde?En sovende ung ulv med elektroder. Kredit:Institut for Etologi / Eötvös Loránd University Forskere ved Institut for Etologi ved Eötvös Loránd Universitet i Ungarn har for første gang målt søvnen ho
Sover ulve som hunde?En sovende ung ulv med elektroder. Kredit:Institut for Etologi / Eötvös Loránd University Forskere ved Institut for Etologi ved Eötvös Loránd Universitet i Ungarn har for første gang målt søvnen ho -
 Landbrug og gødning:hvordan økologiske praksisser kan gøre en forskelKredit:CC0 Public Domain Landbrug indebærer en vanskelig balance mellem fødevareproduktion og miljøpåvirkning. For eksempel kan gødning bidrage til at opnå gode afgrødeudbytter, men overforbrug af
Landbrug og gødning:hvordan økologiske praksisser kan gøre en forskelKredit:CC0 Public Domain Landbrug indebærer en vanskelig balance mellem fødevareproduktion og miljøpåvirkning. For eksempel kan gødning bidrage til at opnå gode afgrødeudbytter, men overforbrug af -
 Hvorfor vi ikke skal være for hurtige til at give migrerende dyr skylden for global sygdomDen rødhalsede stint er meget udsat for sedimentmikrober, når den fouragerer efter de mikroskopiske hvirvelløse dyr, der giver næring til dens enorme migrationer. Forfatter angivet Er du nogensind
Hvorfor vi ikke skal være for hurtige til at give migrerende dyr skylden for global sygdomDen rødhalsede stint er meget udsat for sedimentmikrober, når den fouragerer efter de mikroskopiske hvirvelløse dyr, der giver næring til dens enorme migrationer. Forfatter angivet Er du nogensind -
 Disse ringhale-lemurer stinker, når de flirter med potentielle kammeraterKredit:Devin Sturgeon/University of Toronto En U of T Scarborough-undersøgelse finder, at et unikt ritual udført af ringhale-mandlige lemurer kan have betydelige fysiske omkostninger, men det kunn
Disse ringhale-lemurer stinker, når de flirter med potentielle kammeraterKredit:Devin Sturgeon/University of Toronto En U of T Scarborough-undersøgelse finder, at et unikt ritual udført af ringhale-mandlige lemurer kan have betydelige fysiske omkostninger, men det kunn


