Hvordan superbugs bruger spejlbilleder til at skabe antibiotikaresistens
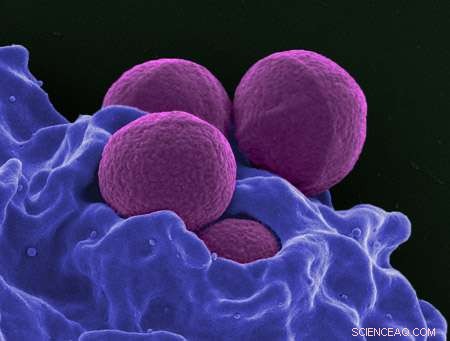
Et farvet scanningselektronmikrografi af MRSA. Kredit:National Institute of Allergy and Infectious Diseases
Methicillin-resistente Staphylococcus aureus (MRSA) er en bakteriel infektion, der er blevet resistent over for de fleste af de antibiotika, der bruges til at behandle almindelige staph-infektioner. Duke University datalog Bruce Donald og samarbejdspartnere ved University of Connecticut arbejder på at udvikle nye enzymhæmmere til at bekæmpe MRSA. I forskning offentliggjort i PLOS Computational Biology , opdagede holdet, hvordan en enkelt lille mutation gør en stor forskel i lægemiddeleffektiviteten.
De undersøgte dihydrofolatreduktase (DHFR), et enzym, som antibiotika er målrettet mod at bekæmpe MRSA. Lægemidler, der hæmmer DHFR, virker lidt ligesom låse og nøgler; de binder sig til enzymer i MRSA, som har en specifik tredimensionel struktur, der kun tillader molekyler, der passer præcist, at binde sig til dem.
En mutation kan ændre strukturen af et bakterielt enzym og få lægemidler til at miste effektiviteten. F98Y-mutationen er en velkendt resistensmutation. En lille ændring i den 98. aminosyre i DHFR-enzymet ændrer en phenylalanin til en tyrosin. "De to aminosyrer er strukturelt ens," sagde Graham Holt, kandidatstuderende i Donald-laboratoriet, "men mutationen har en enorm effekt på inhibitorernes effektivitet." I det væsentlige ændrer det låsen.
Pablo Gainza, Ph.D., tidligere kandidatstuderende i Donald-laboratoriet, mente, at han burde være i stand til at forudsige denne mutation ved hjælp af OSPREY, en suite af programmer til beregningsstruktur-baseret proteindesign udviklet i Donald-laben. Men det kunne han ikke. Efter at have slået hypotese ned efter hypotese for at finde ud af, hvorfor han ikke var i stand til at forudsige denne mutation, gik han tilbage for at undersøge startstrukturen.
"Vi kiggede på elektrondensitetsdataene fra krystallografen og fandt noget mærkeligt," sagde Donald. I forsøget på at bestemme strukturen af F98Y-mutanten brugte krystallografer et computerprogram, der - uden at de vidste - vendte chiraliteten eller lavede et spejlbillede af NADPH-kofaktoren for at få en bedre tilpasning. De "vendte" kemiske arter, de opdagede gennem deres analyse, eksisterer under eksperimentelle forhold i laboratoriet og sandsynligt in vivo.
"Ved at bruge OSPREY opdagede vi denne vendte chiralitet," sagde Donald, "som vi tror skete på grund af F98Y-mutationen." Som i 2-faktor autentificering ser den enkelte enzymmutation og den vendte cofaktor ud til at konspirere sammen for at undgå inhibitoren.
Denne "kirale undvigelse" ændrer det strukturelle grundlag for modstand. Men nu ved Anders og kolleger ikke kun, hvordan en enkelt lille mutation ændrede låsen, men også den struktur, de skal bruge for at lave en bedre nøgle - en bedre lægemiddelhæmmer.
"Dette er det første eksempel på et enzym, der udnytter chiraliteten af dets cofaktor for at undgå dets inhibitorer," sagde Holt. "Nu hvor vi ser dette ske, vil det hjælpe med at informere om beregningsstrategier for at udvikle bedre inhibitorer."
Donald-laboratoriet viste, at ved at tage vendt chiralitet i betragtning, matcher OSPREYs forudsigelser nøje eksperimentelle målinger af inhibitorstyrke. De arbejdede med samarbejdspartnere ved University of Connecticut, som udførte biokemiske eksperimenter for at teste teorien og give strukturelle beviser.
"Dette er kun begyndelsen på historien," sagde Donald. "Vores opdagelse af chiral unddragelse burde føre til mere modstandsdygtige hæmmere:bedre lægemiddeldesign." Lige nu er det meste lægemiddeldesign reaktivt og venter på, at der opstår resistens, hvilket det altid gør. "Vi håber at gøre lægemiddeldesign proaktivt ved at bruge vores algoritmer til at forudse resistens," sagde Donald.
 Varme artikler
Varme artikler
-
 Test af chimpanser i Tanzania gennem årtier tyder på, at personlighedstyper er stabileKredit:CC0 Public Domain Et team af forskere tilknyttet institutioner i USA, Storbritannien og Tanzania har fundet beviser, der tyder på, at personlighedstræk hos chimpanser er relativt stabile ov
Test af chimpanser i Tanzania gennem årtier tyder på, at personlighedstyper er stabileKredit:CC0 Public Domain Et team af forskere tilknyttet institutioner i USA, Storbritannien og Tanzania har fundet beviser, der tyder på, at personlighedstræk hos chimpanser er relativt stabile ov -
 Sådan opretter du et bakterieflowdiagramBakterielle flowdiagrammer giver et visuelt hjælpemiddel til hurtig identifikation af bakteriearter. For at skabe et flowdiagram skal du identificere de fælles karakteristika for de forskellige gruppe
Sådan opretter du et bakterieflowdiagramBakterielle flowdiagrammer giver et visuelt hjælpemiddel til hurtig identifikation af bakteriearter. For at skabe et flowdiagram skal du identificere de fælles karakteristika for de forskellige gruppe -
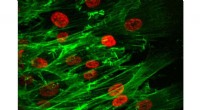 Fundet probe celle samarbejde, en masse migrationDette billede viser gruppemigreringen af celler, med rødt, der angiver cellekernerne, og det grønne repræsenterer cellens cytoskelet. Kredit:Purdue University foto/Bumsoo Han Nye forskningsresul
Fundet probe celle samarbejde, en masse migrationDette billede viser gruppemigreringen af celler, med rødt, der angiver cellekernerne, og det grønne repræsenterer cellens cytoskelet. Kredit:Purdue University foto/Bumsoo Han Nye forskningsresul -
 Hvordan teknologi giver os mulighed for at afsløre hemmelighederne bag Amazonas biodiversitetTropiske skove er ofte mørke miljøer, hvor det kan være meget udfordrende at observere dyrelivet, på trods af at de rummer en uforholdsmæssig stor mængde af verdens biodiversitet. Kredit:Oliver Metcal
Hvordan teknologi giver os mulighed for at afsløre hemmelighederne bag Amazonas biodiversitetTropiske skove er ofte mørke miljøer, hvor det kan være meget udfordrende at observere dyrelivet, på trods af at de rummer en uforholdsmæssig stor mængde af verdens biodiversitet. Kredit:Oliver Metcal
- Hybridmateriale flytter næste generations transportbrændstofceller tættere på
- Autosalg i USA er fortsat langsomt i tredje kvartal
- Forskellen mellem vandplanter og landplanter
- Kirigami-design holder tusindvis af gange deres egen vægt
- Bill, der giver beskyttelse til Uber-chauffører, andre bevæger sig fremad
- Hvordan Uber og andre digitale platforme kunne narre os ved at bruge adfærdsvidenskab – medmindre v…


