Sådan får du chloridioner ind i cellen
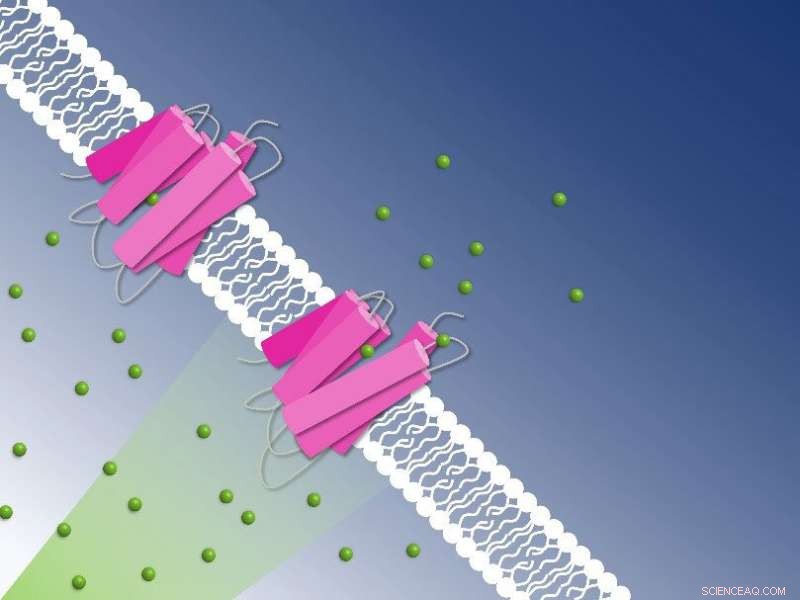
Fotoaktivt klorid, der pumper gennem cellemembranen, fanget ved tidsopløst seriel krystallografi:Chloridioner (grønne kugler) transporteres gennem cellemembranen af NmHR-kloridpumpen (lyserød). Kredit:Guillaume Gotthard og Sandra Mous
Mange bakterier og encellede alger har lysdrevne pumper i deres cellemembraner:proteiner, der ændrer form, når de udsættes for fotoner, således at de kan transportere ladede atomer ind eller ud af cellen. Takket være disse pumper kan deres encellede ejere tilpasse sig miljøets pH-værdi eller saltholdighed.
En sådan bakterie er Nonlabens marinus, først opdaget i 2012 i Stillehavet. Det har blandt andet et rhodopsin-protein i sin cellemembran, som transporterer chloridanioner fra ydersiden af cellen til dens indre. Ligesom i det menneskelige øje, isomeriserer et nethindemolekyle bundet til proteinet, når det udsættes for lys. Denne isomerisering starter pumpeprocessen. Forskere fik nu detaljeret indsigt i, hvordan kloridpumpen i Nonlabens marinus fungerer.
Undersøgelsen blev ledet af Przemyslaw Nogly, engang postdoc ved PSI og nu Ambizione Fellow og gruppeleder ved ETH Zürich. Med sit team kombinerede han eksperimenter på to af PSI's store forskningsfaciliteter, Swiss Light Source SLS og røntgenfri-elektronlaseren SwissFEL. Langsommere dynamik i millisekundområdet blev undersøgt via tidsopløst seriel krystallografi ved SLS, mens hurtigere, op til picosekunder, hændelser blev fanget ved SwissFEL – derefter blev begge datasæt sat sammen.
"I et papir udnytter vi fordelene ved to avancerede faciliteter til at fortælle hele historien om denne kloridpumpe," siger Nogly. Jörg Standfuss, medforfatter af undersøgelsen, som opbyggede et PSI-hold dedikeret til at skabe sådanne molekylære film, tilføjer, at "denne kombination muliggør førsteklasses biologisk forskning, som kun ville være mulig på meget få andre steder i verden ved siden af PSI."

Lyserøde krystaller afslører mekanismen for chloridtransport over cellemembranen:Ved hjælp af tidsopløst seriel krystallografi afslørede de lyserøde NmHR-krystaller ionbindingssteder i chloridtransportøren og pumpedynamik efter fotoaktivering. Dette gjorde det muligt for forskere at dechifrere kloridtransportmekanismen. Kredit:Sandra Mous
Ingen tilbageløb
Som undersøgelsen har afsløret, tiltrækkes chloridanionen af et positivt ladet område af rhodopsin-proteinet i Nonlabens marinus' cellemembran. Her kommer anionen ind i proteinet og binder sig til sidst til en positiv ladning ved retinalmolekylet indeni. Når nethinden isomeriserer på grund af lyspåvirkning og vælter, trækker den kloridanionen med og transporterer den dermed et stykke længere inde i proteinet. "Det er sådan, lysenergi omdannes direkte til kinetisk energi, hvilket udløser det allerførste trin i iontransporten," siger Sandra Mous, ph.d. elev i Noglys gruppe og førsteforfatter af papiret.
At være på den anden side af nethindens molekyle nu, har chloridionen nået et point of no return. Herfra går det kun længere inde i cellen. En aminosyrespiral slapper også af, når klorid bevæger sig med, og forhindrer desuden passagen udenfor. "Under transporten sørger to molekylære porte således for, at klorid kun bevæger sig i én retning:indenfor," siger Nogly. En pumpeproces i alt tager omkring 100 millisekunder.
For to år siden optrevlede Jörg Standfuss, Przemyslaw Nogly og deres team mekanismen i en anden lysdrevet bakteriepumpe:natriumpumpen fra Krokinobacter eikastus. Forskere er ivrige efter at opdage detaljerne i lysdrevne pumper, fordi disse proteiner er værdifulde optogenetiske værktøjer:Genmanipuleret til pattedyrneuroner gør de det muligt at kontrollere neuronernes aktiviteter med lys og dermed forske i deres funktion.
 Varme artikler
Varme artikler
-
 Pattedyrs hjerner identificerer typen af duft hurtigere end engang troedeKredit:CC0 Public Domain Det tager mindre end en tiendedel af et sekund-en brøkdel af den tid, man tidligere troede-for lugtesansen at skelne mellem en lugt og en anden, viser nye forsøg med mus.
Pattedyrs hjerner identificerer typen af duft hurtigere end engang troedeKredit:CC0 Public Domain Det tager mindre end en tiendedel af et sekund-en brøkdel af den tid, man tidligere troede-for lugtesansen at skelne mellem en lugt og en anden, viser nye forsøg med mus. -
 Eksperiment-id'er indflydelse af antibiotika, isolering på værtsbakterierDaphnia magna, en art af millimeterskala krebsdyr. Kredit:Shutterstock Bakterier udvikler og anvender jævnligt nye antibiotika i et uendeligt våbenkapløb for at dræbe andre bakteriearter, der konku
Eksperiment-id'er indflydelse af antibiotika, isolering på værtsbakterierDaphnia magna, en art af millimeterskala krebsdyr. Kredit:Shutterstock Bakterier udvikler og anvender jævnligt nye antibiotika i et uendeligt våbenkapløb for at dræbe andre bakteriearter, der konku -
 Internationalt samarbejde arbejder på at avle svamperesistent bomuld(a, b) Gossypium barbadense, GB1368/k-7616, en Usbekistan-tiltrædelsesintroduktion med forskellig plantestruktur, store blade, søjlevækst og frugtklyngevane. (c) Fuldvandet plante fra PSSJ-FRP01 kimpl
Internationalt samarbejde arbejder på at avle svamperesistent bomuld(a, b) Gossypium barbadense, GB1368/k-7616, en Usbekistan-tiltrædelsesintroduktion med forskellig plantestruktur, store blade, søjlevækst og frugtklyngevane. (c) Fuldvandet plante fra PSSJ-FRP01 kimpl -
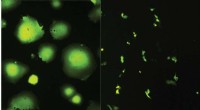 Målretning mod et enkelt protein kan behandle en bred vifte af viraMæslingevirus undertrykkes (til højre), når et nøgleprotein, SPCA1, er nedsat i værten. Kredit:Hans-Heinrich Hoffmann De fleste lægemidler, der bekæmper vira, er designet til at målrette individue
Målretning mod et enkelt protein kan behandle en bred vifte af viraMæslingevirus undertrykkes (til højre), når et nøgleprotein, SPCA1, er nedsat i værten. Kredit:Hans-Heinrich Hoffmann De fleste lægemidler, der bekæmper vira, er designet til at målrette individue
- Hej Google, du ønsker ikke rigtig at erstatte mig, ret?
- Sådan rapporteres en stikstørrelse
- Banebrydende Adaptive Optics Facility ser det første lys
- Kæmpe Puerto Rico-radioteleskop, der lukker i slag for videnskaben
- Kønsbestemt syn på druk:En fortælling om to premierministre
- Påvisning af det uopdagelige i prostatacancertestning


