Forskere afslører protein SRSF1s usædvanlige evne til at binde og udfolde RNA G-quadruplexes
RNA-transkription er den genomiske proces, hvor en celle producerer en duplikat af et gens DNA-sekvens. I en undersøgelse offentliggjort i Nucleic Acids Research , University of Alabama i Birmingham Department of Chemistry Professor Jun Zhang, Ph.D., og hans team afslører, hvordan proteinet SRSF1 har den nye funktion at binde og udfolde komplekse RNA Guanin-quadruplexes.
Til stede i både DNA- og RNA-sekvenser er en G-quadruplex (GQ) en struktur af fire guaninbaser bundet i et plant array. Disse arrays, kendt som G-tetrad, er forbundet via Hoogsteen baseparringer. Det ses almindeligvis, at tre eller flere lag af G-tetrader er det, der udgør en GQ-struktur.
I en normalt fungerende celle afvikles de fleste GQ'er til sidst, så informationen kodet af RNA'et kan bruges til proteinekspression. GQ'er bruges almindeligvis til at regulere proteinekspressionsniveauet. Men på grund af den ekstreme stabilitet af deres strukturer er GQ'er relativt vanskelige at afvikle, når de først er dannet i celler.
For eksempel, hvis GQ ikke er afviklet, kan ribosomet ikke passere igennem, og det nødvendige protein kan ikke produceres. Denne regulerende funktion er vigtig, fordi hvis proteinet fungerer til at undertrykke kræftceller, så kan en manglende evne til at afvikle en GQ-sekvens resultere i replikation af kræftceller og ondsindede celler.
"Dette er vigtigt, fordi forståelse af, hvordan vi nemt kan åbne GQ-strukturer, kunne give en anden vej ind i fremtiden for behandlingsmuligheder for visse sygdomme," sagde Zhang. "Der er tidligere ingen andre eksterne værktøjer, som vi nemt kan bruge til at åbne disse strukturer i cellen."
Zhang og hans team forskede i den Ser/Arg-rige, eller SR, proteinfamilie.
Der er 12 medlemmer af SR-proteinfamilien. Denne familie af RNA-bindende proteiner er mest kendt for RNA-splejsning. SRSF1 overvåger splejsningen af mere end 1.500 forskellige messenger-RNA-transkripter.
"Fejlfunktion af splejsning kan resultere i udvikling af forskellige sygdomme såsom kræft," sagde Zhang. "Omkring 60 % af sygdommene kan faktisk tilskrives fejlfunktion ved splejsning."
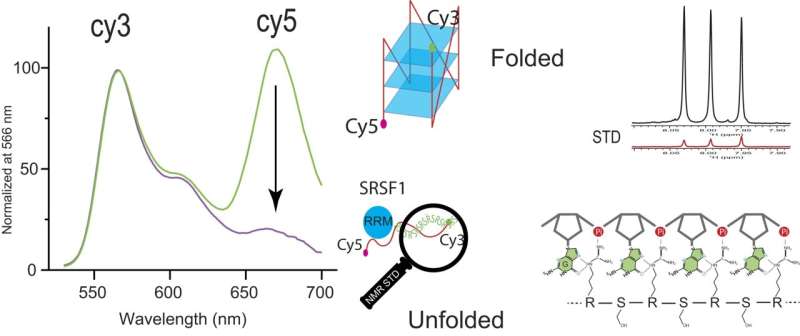
Hvert medlem af SR-proteinfamilien består af et eller to N-terminale RNA-genkendelsesmotiver eller RRM'er og en phosphorylerbar C-terminal proteinregion rig på gentagne Arg/Ser-dipeptider eller RS.
Zhangs laboratorium er det første, der med succes solubiliserer SRSF1 i fuld længde i sin oprindelige tilstand. Zhangs team brugte dette til at udforske det RNA-bindende landskab af SRSF1. Ved at gøre det med succes fandt Zhangs team ud af, at SRSF1 RS foretrækker purin frem for pyrimidin.
Ved at bruge fluorescensresonansenergioverførsel, eller FRET, mellem fluorescerende kemikalier Cy3 og Cy5, var Zhang og hans team i stand til at se det signifikante Cy5-signalfald ved tilføjelse af SRSF1. Dette fald betyder en kooperativ binding af SRSF1 til ARPC2 GQ og udfoldelse af ARPC2 GQ.
"Vores resultater er kun en begyndelse til at forstå de bredere roller SR-proteiner spiller i RNA-splejsning og translation," sagde Zhang. "Det er vigtigt at forstå disse egenskaber, fordi det hjælper os til bedre at forstå, hvordan proteinekspression reguleres inde i cellen."
Flere oplysninger: Naiduwadura Ivon Upekala De Silva et al., Udgravning af en ny funktion af SRSF1 i binding og udfoldelse af RNA G-quadruplexes, Nucleic Acids Research (2024). DOI:10.1093/nar/gkae213
Journaloplysninger: Nukleinsyreforskning
Leveret af University of Alabama i Birmingham
 Varme artikler
Varme artikler
-
 Forskere afslører, hvordan stamceller træffer beslutningerKredit:Leiden Universitet Embryonale stamceller har den bemærkelsesværdige evne til at udvikle sig til enhver type celle. På vej til at blive for eksempel en lever eller en hjertecelle, de skal ge
Forskere afslører, hvordan stamceller træffer beslutningerKredit:Leiden Universitet Embryonale stamceller har den bemærkelsesværdige evne til at udvikle sig til enhver type celle. På vej til at blive for eksempel en lever eller en hjertecelle, de skal ge -
 Vi stod over for misbrug for at bede folk om at dræbe hvepse til videnskab - her er hvorfor det var…Kredit:shutterstock Da vi lancerede et borgervidenskabeligt projekt tidligere på året, vi forventede ikke at komme i så mange problemer. Vi ville offentligt hjælpe os med at finde ud af mere om s
Vi stod over for misbrug for at bede folk om at dræbe hvepse til videnskab - her er hvorfor det var…Kredit:shutterstock Da vi lancerede et borgervidenskabeligt projekt tidligere på året, vi forventede ikke at komme i så mange problemer. Vi ville offentligt hjælpe os med at finde ud af mere om s -
 Er John James Audubons tidligere ugerninger kommet hjem for at hvile?Kredit:Det Hvide Hus, Public domain, via Wikimedia Commons Det var en risiko, som sandsynligvis ikke blev opfattet tilbage i 1886, da Forest and Stream-magasinets redaktør George Bird Grinnell, for
Er John James Audubons tidligere ugerninger kommet hjem for at hvile?Kredit:Det Hvide Hus, Public domain, via Wikimedia Commons Det var en risiko, som sandsynligvis ikke blev opfattet tilbage i 1886, da Forest and Stream-magasinets redaktør George Bird Grinnell, for -
 Nye fremskridt inden for biologisk fiksering af nitrogen i risUdtryk af ris-afledt OsNifHHt og OsNifMAv . Relative mRNA-ekspressionsniveauer af OsnifHHt og OsnifMAv i tre forskellige (uafhængige biologiske replikater) risplantelinjer (a) og de tilsvarende callus
Nye fremskridt inden for biologisk fiksering af nitrogen i risUdtryk af ris-afledt OsNifHHt og OsNifMAv . Relative mRNA-ekspressionsniveauer af OsnifHHt og OsnifMAv i tre forskellige (uafhængige biologiske replikater) risplantelinjer (a) og de tilsvarende callus
- Forskere gennemfører formidling af højfrekvent tidsfrekvens
- Sådan laver du julemiddagen på den mest miljøvenlige måde
- Leviathan polymer børste lavet med E. coli holder bakterier i skak
- Billede:Kigger ind i Cheops-teleskoprøret
- Papirkurv til skat:Forskere konverterer kommunalt affald til biobrændstofforstadier
- Team opdager nye mekanismer til DNA-stabilitet


