DNA-reparationsmekanisme yderligere belyst i kryo-elektronmikroskopi-eksperiment
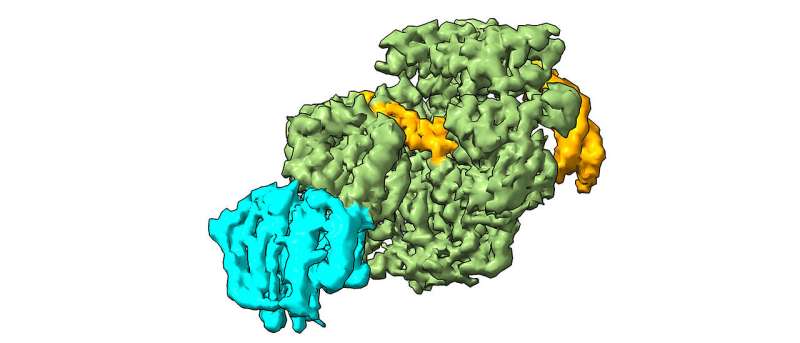
Forskere har opdaget, hvordan proteinet XPD registrerer alvorlige DNA-skader og kontrollerer dets reparation.
XPD-proteinet er en central komponent i vores krops eget "DNA-reparationsteam", kendt som nukleotidudskæringsreparation (NER). Som en snifferhund registrerer NER markerede områder med skader, sporer det beskadigede DNA og rekrutterer andre reparationsproteiner til at skære ud og erstatte de defekte sektioner. Hos raske mennesker forhindrer XPD for eksempel udviklingen af hudkræft ved at detektere og reparere UV-beskadiget DNA.
Et team af forskere ved universitetet i Würzburg (JMU) har nu for første gang opdaget præcis, hvordan XPD-proteinet er i stand til at detektere og verificere tilstedeværelsen af DNA-skader. Holdet blev ledet af biokemikeren Caroline Kisker, formand for strukturel biologi ved Rudolf Virchow Center i Würzburg, i samarbejde med kemikeren Claudia Höbartner fra Institut for Organisk Kemi. Undersøgelsen er publiceret i Nature Structural &Molecular Biology .
Undersøgelse af alvorlig DNA-skade
Würzburg-teamet fokuserede på, hvordan XPD-proteinet virker i interstreng-tværbinding - en af de mest alvorlige former for DNA-skader kendt. Det er for eksempel forårsaget af miljøgifte og industrikemikalier. "Tværbinding mellem strenge får DNA til at blive forkert kopieret og aflæst under celledeling," forklarer Kisker. "Dette fører til genetiske skader, der kan udløse kræft."
I deres undersøgelse brugte forskerne kryo-elektronmikroskopi til at analysere, hvordan XPD afvikler den dobbelte helix af DNA for at afsløre de defekte steder for interstreng-tværbinding, og skabte en model for, hvordan skaden opdages og fjernes.
"Resultaterne fra vores arbejde danner grundlag for nye tilgange til behandling af forskellige former for kræft," siger Jochen Kuper, medlem af Kiskers team. "Ved specifikt at svække reparationsmekanismer såsom NER i kræftceller, kunne vi øge effektiviteten af lægemidler betydeligt."
I yderligere undersøgelser planlægger forskerholdet at undersøge, hvordan XPD opdager forskellige andre typer af DNA-skader.
Flere oplysninger: Jochen Kuper et al., XPD stoppet på tværbundet DNA giver indsigt i skadeverifikation, Nature Structural &Molecular Biology (2024). DOI:10.1038/s41594-024-01323-5
Journaloplysninger: Naturens strukturelle og molekylære biologi
Leveret af Julius-Maximilians-Universität Würzburg
 Varme artikler
Varme artikler
-
 Hvad er lykkeprojektet?Din plan om at forfølge lykke er blevet afsporet af en tandlæge. Sikke en overraskelse. © iStockphoto.com/Casarsa Det sker igen. Igåraftes, du piskede din arbejdsbyrde i form efter at have tilbragt f
Hvad er lykkeprojektet?Din plan om at forfølge lykke er blevet afsporet af en tandlæge. Sikke en overraskelse. © iStockphoto.com/Casarsa Det sker igen. Igåraftes, du piskede din arbejdsbyrde i form efter at have tilbragt f -
 Mød Madagaskars ældste dyreslægt, en hvirvlende bille med 206 millioner år gammel oprindelseH. milloti dorsal habitus. Kredit:KU Nyhedstjeneste Der er dyrebare få arter i dag i biodiversitetens hotspot på Madagaskar, som videnskabsmænd kan spore direkte tilbage til, da alle Jordens kont
Mød Madagaskars ældste dyreslægt, en hvirvlende bille med 206 millioner år gammel oprindelseH. milloti dorsal habitus. Kredit:KU Nyhedstjeneste Der er dyrebare få arter i dag i biodiversitetens hotspot på Madagaskar, som videnskabsmænd kan spore direkte tilbage til, da alle Jordens kont -
 Ny forudsigelsesmodel for vendepunkter giver indsigt i faldende bi -kolonierNetværk A:Data fra Hicking, Norfold, Storbritannien - 62 bestøvere, 17 planter og 146 mutualistiske interaktioner. Netværk B:Data fra Hestehaven, Danmark - 42 bestøver 8 planter og 79 mutualistiske fo
Ny forudsigelsesmodel for vendepunkter giver indsigt i faldende bi -kolonierNetværk A:Data fra Hicking, Norfold, Storbritannien - 62 bestøvere, 17 planter og 146 mutualistiske interaktioner. Netværk B:Data fra Hestehaven, Danmark - 42 bestøver 8 planter og 79 mutualistiske fo -
 Sådan fungerede Albert Einsteins hjerneAlbert Einstein, 13 måneder før hans død. Se flere hjernebilleder. American Stock/Hulton Archive/Getty Images I hans sidste leveår, Albert Einstein vidste, at han var syg og nægtede operationer, der
Sådan fungerede Albert Einsteins hjerneAlbert Einstein, 13 måneder før hans død. Se flere hjernebilleder. American Stock/Hulton Archive/Getty Images I hans sidste leveår, Albert Einstein vidste, at han var syg og nægtede operationer, der


