Forskere belyser substratgenkendelse og protonkoblingsmekanisme for transporterprotein VMAT2
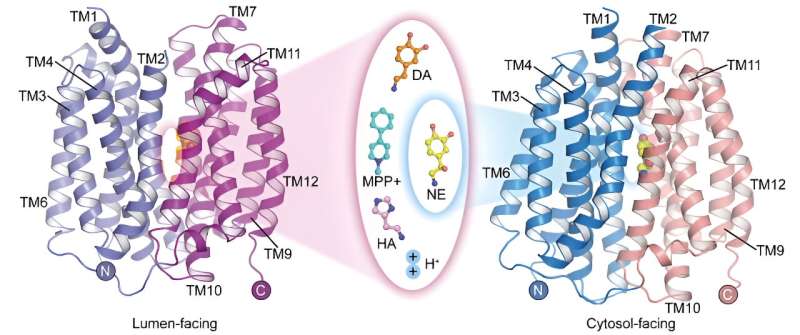
Vesikulær monoamintransporter 2 (VMAT2) er det eneste transportørprotein i centralnervesystemet, der medierer lagringen af monoamin-neurotransmittere. Det spiller en afgørende rolle i at formidle nerveimpulstransmission og neurobeskyttelse.
I øjeblikket er de mekanismer, hvorved VMAT2 genkender og transporterer adskillige strukturelt forskellige monoamin-neurotransmittere og Parkinsons sygdomsinduceren MPP + er ikke klare, og den molekylære mekanisme for protonkoblet substrattransport skal også udforskes yderligere.
I en undersøgelse offentliggjort i Cell Research den 22. maj har et forskerhold ledet af prof. Zhao Yan fra Institut for Biofysik ved Det Kinesiske Videnskabsakademi (CAS) i samarbejde med prof. Jiang Daohua fra Institut for Fysik i CAS rapporteret om apo-strukturen af mennesker vesikulær monoamintransportør 2 (hVMAT2) ved lav pH, de komplekse strukturer af vesikler, der vender mod dopamin, noradrenalin, histamin og neurotoksinet MPP + binding og den komplekse struktur af noradrenalinbinding i den cytosolvendte tilstand.
Disse strukturer afslører det strukturelle grundlag for VMAT2-substratgenkendelse og forfiner yderligere den molekylære mekanisme for protonkoblet substrattransport.
Selvom noradrenalin, dopamin, serotonin og MPP + har forskellige molekylære strukturer, viser de komplekse strukturer af VMAT2-binding til disse substrater, at de alle binder til lignende positioner på transporterproteinet. Imidlertid fører subtile forskelle i visse funktionelle grupper af disse substrater til signifikante og kritiske forskelle i deres interaktioner og bindingsmåder med transporterproteinet. Disse forskelle illustrerer, hvordan VMAT2 effektivt genkender forskellige substratmolekyler.
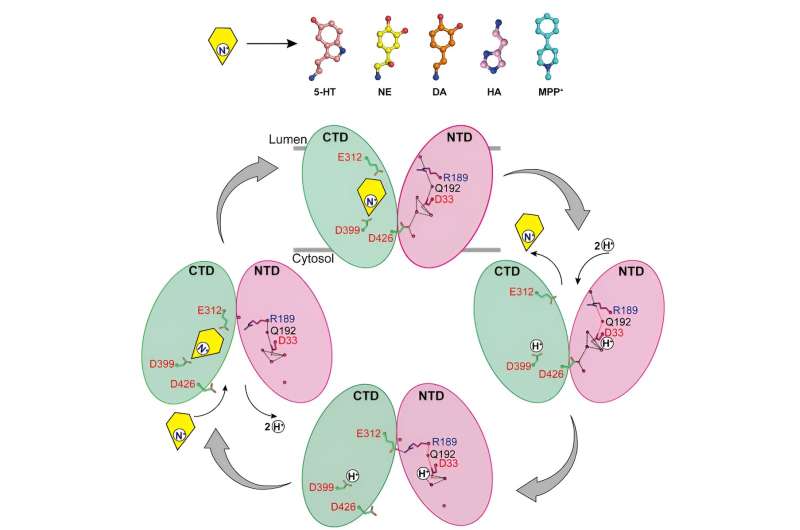
Forskerne rapporterede strukturerne af noradrenalin, der binder til VMAT2 i forskellige konformationer, herunder de cytosol-vendte og vesikel-vendende konformationer.
På trods af betydelige konformationelle ændringer i VMAT2 forbliver substratbindingslommen for noradrenalin relativt stabil under denne proces, uden signifikante ændringer i interaktioner med omgivende rester. Denne smarte konformationelle overgang er afgørende for funktionen af VMAT2.
Ved at analysere strukturerne af VMAT2 ved forskellige pH-forhold blev det bekræftet, at D33 kan være et andet nøgleprotonationssted.
Ved grundigt at analysere de mekanismer, hvorved VMAT2 genkender forskellige strukturelt forskellige monoamin-neurotransmittere og neurotoksiner, foreslår dette arbejde en molekylær model for VMAT2-konformationelle ændringer og forfiner yderligere den specifikke mekanisme for protonkoblet substrattransport.
Disse resultater giver værdifuld indsigt til en omfattende forståelse af VMAT2-transporttilstanden, beriger vidensystemet for den store facilitator-superfamilie-substrattransport og lægger et vigtigt grundlag for lægemiddeludvikling og -optimering.
Flere oplysninger: Di Wu et al., Strukturelle snapshots af menneskelig VMAT2 afslører indsigt i substratgenkendelse og protonkoblingsmekanisme, Cell Research (2024). DOI:10.1038/s41422-024-00974-9
Journaloplysninger: Celleforskning
Leveret af Chinese Academy of Sciences
 Varme artikler
Varme artikler
-
 Hvordan måler du lykke?Danmark er et af de lykkeligste lande i verden. Se flere følelsesbilleder. © iStockphoto.com/RichVintage Danskerne skal gøre noget rigtigt. I 2008, Danmark rangeret som den lykkeligste nation på plan
Hvordan måler du lykke?Danmark er et af de lykkeligste lande i verden. Se flere følelsesbilleder. © iStockphoto.com/RichVintage Danskerne skal gøre noget rigtigt. I 2008, Danmark rangeret som den lykkeligste nation på plan -
 Handelfiner tilbyder gaver for at tiltrække hunnerKredit:CC0 Public Domain Forskere fra University of Western Australia har fanget en sjælden seksuel visning:beviser på pukkelrygdelfiner, der præsenterer hunner for store marine svampe i et tilsyn
Handelfiner tilbyder gaver for at tiltrække hunnerKredit:CC0 Public Domain Forskere fra University of Western Australia har fanget en sjælden seksuel visning:beviser på pukkelrygdelfiner, der præsenterer hunner for store marine svampe i et tilsyn -
 Hvordan sporer du en hemmelighedsfuld høg? Følg isotoperneHensts goshawk. Kredit:Sarah Karpanty/Virginia Tech Professor ved University of Cincinnati Brooke Crowley ønskede at kende jagtområdet for Hensts goshawk, en stor skovlevende rovfugl, der ligger i
Hvordan sporer du en hemmelighedsfuld høg? Følg isotoperneHensts goshawk. Kredit:Sarah Karpanty/Virginia Tech Professor ved University of Cincinnati Brooke Crowley ønskede at kende jagtområdet for Hensts goshawk, en stor skovlevende rovfugl, der ligger i -
 Hvordan udviklede hvirveldyr først kæber?En zebrafisk, der viser skelettet og kæben (magenta), øjet (grøn cirkel på leT) og gællelignende pseudogren og gæller (grønne strukturer til højre). Kredit:Mathi Thiruppathy/Crump Lab For fem hundr
Hvordan udviklede hvirveldyr først kæber?En zebrafisk, der viser skelettet og kæben (magenta), øjet (grøn cirkel på leT) og gællelignende pseudogren og gæller (grønne strukturer til højre). Kredit:Mathi Thiruppathy/Crump Lab For fem hundr
- Idéer til en simpel opfindelse til et skoleprojekt
- Marsquakes rock and roll
- Forskere udvikler det første stof til automatisk at afkøle eller isolere afhængigt af forholdene
- Tak, Statistikker! En hurtigere måde at forbedre mobilapps på
- Forskere lod dybden af verdens højeste gejser
- Forskere, der arbejder på at få robotter på størrelse med molekyler til at sværme sammen for at…


