Undersøgelse identificerer ny topogenese-vej til foldning og samling af multi-spændende membranproteiner
Forskere ledet af prof. Zhang Zairong fra Shanghai Institute of Organic Chemistry ved det kinesiske videnskabsakademi har identificeret en post-translationel topogenese-vej til foldning og samling af multi-spændende membranproteiner (MSP'er).
Ud af de omkring 5.000 membranproteiner, der syntetiseres ved den endoplasmatiske reticulum (ER) membran af menneskelige celler, er mere end halvdelen MSP'er, der spiller kritiske roller i cellulær og organismefysiologi, og fungerer som ionkanaler, transportører, receptorer og intramembrane enzymer.
En betydelig del af disse funktioner er afhængige af polære og ladede aminosyrer, hvilket fører til dannelsen af dårligt hydrofobe TMD'er (pTMD'er). Imidlertid står pTMD'er over for udfordringer med at blive genkendt og integreret i phospholipid-dobbeltlaget af Sec61-translokonet, som foretrækker hydrofobe TMD'er.
I det humane proteom indeholder ca. 30 % af membranproteiner og mere end 50 % af MSP'er mindst én pTMD. Hvordan disse pTMD'er effektivt identificeres og pakkes præcist ind i modne MSP-strukturer har været et stort videnskabeligt spørgsmål.
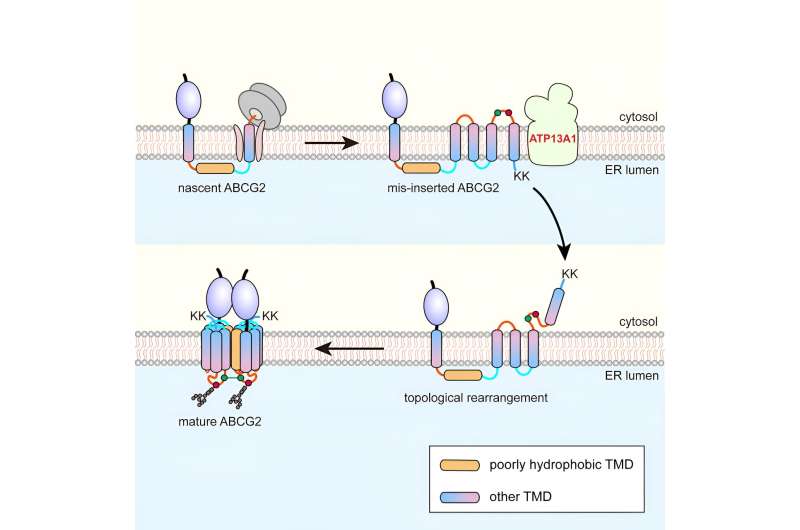
Ved at bruge den seks-spændende protein adenosin triphosphat-bindende kassettetransporter G2 (ABCG2) som en model, fandt forskerne, at under co-translationel translokation passerer ABCG2's pTMD2 gennem den centrale pore af translokonet ind i ER-lumenet i stedet for at blive integreret i fosfolipid-dobbeltlaget gennem translokonets laterale gate.
Dette resulterer i indsættelse af nedstrøms TMD'er i ER-membranen med omvendt orientering, hvorved der dannes et unikt mellemprodukt. Efter translationen af de C-terminale positivt ladede tvillingelysinrester sker der en næsten global topologisk omlejringsproces.
Affinitetsoprensning viste, at ATP13A1 kan detektere det C-terminale positive ladningssignal af ABCG2. Udskiftning af lysinrester med negativt ladede eller neutrale aminosyrer dæmper interaktionerne mellem ATP13A1 og ABCG2 mutanter signifikant.
Desuden resulterede knockout af ATP13A1 i den tilsyneladende akkumulering af fejlfoldede ABCG2-konformationer, primært dem med forkert orienteret TMD6 i ER-membranen. Således spiller ATP13A1 en afgørende rolle i topogenesen af MSP'er, hvor dens ATPase-aktivitet fremmer dislokationen af det misorienterede TMD6 fra lipid-dobbeltlaget ind i cytosolen.
Efterfølgende genintegreres den cytosoliske TMD6 i ER-membranen, hvorved den post-translationelle topologiske omlejring af andre opstrøms TMD'er drives.
Efter vellykket omarrangering af TMD'er 4-6 kan mellemproduktet oligomerisere til en kvaternær struktur. Denne proces vil sandsynligvis lette integrationen af pTMD2 i den endelige struktur fra det vandige ER-lumen og ind i den modne struktur, som er tæt pakket ind af omgivende TMD'er.
Sammenfattende er undersøgelsen, nu offentliggjort i Molecular Cell , forklarer, hvordan en "vanskelig" pTMD co-translationelt springes over til indsættelse og post-translationelt begraves i den endelige korrekte struktur på det sene foldningsstadium, hvorved man undgår overdreven lipideksponering.
Navnlig på grund af eksponeringen af pTMD2 til ER-lumen under ABCG2-topogenesen, kan N441-glykosyleringsmodifikationen forårsaget af ABCG2-S441N-genmutationen signifikant blokere pTMD-samling på det sene stadium af topogenese. Da ABCG2 er en urinsyretransportør, forklarer denne undersøgelse, hvordan denne mutation er tæt forbundet med menneskelige sygdomme såsom gigt og hyperurikæmi.
Flere oplysninger: Jia Ji et al, En ATP13A1-assisteret topogenesevej til foldning af multi-spændende membranproteiner, Molecular Cell (2024). DOI:10.1016/j.molcel.2024.04.010
Journaloplysninger: Molekylær celle
Leveret af Chinese Academy of Sciences
 Varme artikler
Varme artikler
-
 Hvorfor mennesker skriger,Lav skøre ansigter, når de er bange Stuff to Blow Your Mind:Screams of Terror - Videnskab på nettet HowStuffWorks Uanset om det er på grund af en udflugt til et hjemsøgt hus eller på grund af
Hvorfor mennesker skriger,Lav skøre ansigter, når de er bange Stuff to Blow Your Mind:Screams of Terror - Videnskab på nettet HowStuffWorks Uanset om det er på grund af en udflugt til et hjemsøgt hus eller på grund af -
 Saguaro og andre tårnhøje kaktusser har en forvrænget historieCardón sahueso ( Pachycereus pringlei:Pachycereeae ); den højeste kaktusart i verden. Denne person vokser i Cataviña-regionen på Baja California-halvøen i México. Det er forbundet med en gammel mesq
Saguaro og andre tårnhøje kaktusser har en forvrænget historieCardón sahueso ( Pachycereus pringlei:Pachycereeae ); den højeste kaktusart i verden. Denne person vokser i Cataviña-regionen på Baja California-halvøen i México. Det er forbundet med en gammel mesq -
 Kejserpingviner kan forkorte rekorden hurtigt ved at snackVoksne med kyllinger. Kredit:Public Domain Kejserpingvinernes udholdenhed, trasker gennem den evige antarktiske nat til deres avlskolonier, er legendarisk. Mange vandrer mere end 100 km fra deres
Kejserpingviner kan forkorte rekorden hurtigt ved at snackVoksne med kyllinger. Kredit:Public Domain Kejserpingvinernes udholdenhed, trasker gennem den evige antarktiske nat til deres avlskolonier, er legendarisk. Mange vandrer mere end 100 km fra deres -
 Ny teknik forbedrer proteoform-billeddannelse i humant vævIllustration af PiMS workflow til proteoform billeddannelse og identifikation. (A) Scanningstilgang (øverst), påvisning af proteoformer i massedomænet (midten) og billedrekonstruktion (nederst). (B) T
Ny teknik forbedrer proteoform-billeddannelse i humant vævIllustration af PiMS workflow til proteoform billeddannelse og identifikation. (A) Scanningstilgang (øverst), påvisning af proteoformer i massedomænet (midten) og billedrekonstruktion (nederst). (B) T


